题目内容
18.用NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,2.24L乙醇分子所含的C-H键数为0.5NA | |
| B. | 3.2克O2和O3的混合气中含有的氧原子数目为0.2NA | |
| C. | 0.1mol•L-1的Al2(SO4)3溶液中,AL3+的数目小于0.2NA | |
| D. | 0.1molFe参加氧化还原反应,转移的电子数目一定是0.3NA |
分析 A、标况下乙醇为液态;
B、氧气和臭氧均由氧原子构成;
C、溶液体积不明确;
D、铁参与反应后的价态不明确.
解答 解:A、标况下乙醇为液态,故不能根据气体摩尔体积来计算其物质的量和C-H键个数,故A错误;
B、氧气和臭氧均由氧原子构成,故3.2g混合物中含有的氧原子的物质的量为n=$\frac{3.2g}{16g/mol}$=0.2mol,故含有的氧原子为0.2NA个,故B正确;
C、溶液体积不明确,故溶液中的铝离子的个数无法计算,故C错误;
D、铁参与反应后的价态不明确,可能为+2价,也可能为+3价,故转移的电子数不一定是0.3NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
8.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.

(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H小于0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为0.4<b≤1.
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2,在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为Ⅱ>Ⅲ>Ⅰ(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素;
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.

(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO与O2设计成燃料电池(以KOH溶液为电解液).该电池的负极反应式为CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
①该反应的△H小于0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>、=或<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2,在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为Ⅱ>Ⅲ>Ⅰ(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图3.
①当温度在300℃~400℃范围时,温度是乙酸生成速率的主要影响因素;
②Cu2Al2O4可溶于稀硝酸,稀硝酸还原产物为NO,写出有关的离子方程式3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
9.汽车尾气中的主要污染物是NO和CO.为减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
则C2合理的数值为D(填字母标号).
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
若a=2,b=1,则c=0.6,达平衡时实验组ii中H2O(g)和实验组iii中CO的转化率的关系为αii(H2O)=αiii(CO)(填“<”、“>”或“=”).
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、
投料比$\frac{n({H}_{2})}{n(CO)}$的变化曲线如图1所示.
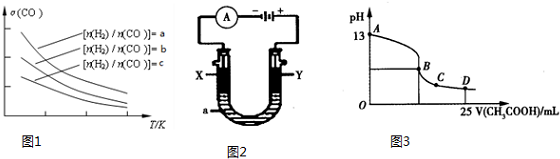
①a、b、c按从大到小的顺序排序为a>b>c.
②根据图象可以判断该反应为放热反应,理由是投料比相同,温度越高CO的转化率越低,平衡向左移动,推得该反应为放热反应.
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-.
①则负极的电极反应式为CO+2O2--2e-=CO32-.
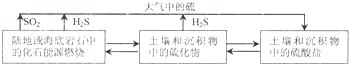
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液电解一段时间后,取25mL 上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中 消耗一氧化碳的质量为2.8g.
(1)2NO(g)+2CO(g)?2CO2(g)+N2(g)△H=-746.5KJ/mol (条件为使用催化剂)
已知:2C (s)+O2(g)?2CO(g)△H=-221.0KJ/mol
C (s)+O2(g)?CO2(g)△H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1.
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
A.4.20 B.4.00 C.2.95 D.2.80
(3)将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,进行反应:H2O(g)+CO(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO | H2 | |||
| i | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
| ii | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
| iii | 900 | a | b | c | d | t |
(4)二甲醚是清洁能源,用CO在催化剂存在下制备二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g),已知一定条件下,该反应中CO的平衡转化率随温度、
投料比$\frac{n({H}_{2})}{n(CO)}$的变化曲线如图1所示.

①a、b、c按从大到小的顺序排序为a>b>c.
②根据图象可以判断该反应为放热反应,理由是投料比相同,温度越高CO的转化率越低,平衡向左移动,推得该反应为放热反应.
(5)CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,能传导O2-.
①则负极的电极反应式为CO+2O2--2e-=CO32-.
②以上述电池为电源,通过导线连接成图2.若X、Y为石墨,a为2L 0.1mol/L KCl溶液电解一段时间后,取25mL 上述电解后的溶液,滴加0.4mol/L醋酸得到图3曲线(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图二计算,上述电解过程中 消耗一氧化碳的质量为2.8g.
13.中国丝绸有五千年的历史和文化.古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮.这种“碱剂”可能是( )
| A. | 食盐 | B. | 火碱 | C. | 草木灰 | D. | 胆矾 |
3.含硫化合物在自然界中广泛存在,部分循环关系如下:
(1)已知:
2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.46kj.mol-1
S(s)+O2(g)═SO2(g)△H=-297.04kJ.mol-1
写出H2S(g)与O2(g)反应产生S(s)和H2O(g)的热化学方程式2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-442.38kJ.mol-1.
(2)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用离子方程式,从沉淀溶解平衡的角度表示由ZnS转变为CuS的过程ZnS(S)+Cu2+(aq)?Zn2+(aq)+CuS(S).
(3)某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至Ph=2,过滤后,将所得滤液蒸发浓缩,冷却结晶,过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
①通入H2S气体至饱和的目的是将溶液中的Sn2+转变为SnS而除去;用硫酸酸化至pH=2的目的是防止Fe2+转化为FeS沉淀.
②在SnS、FeS共存的溶液中,若c(Sn2+)=1.0×10-9mol•L-1,则c(Fe2+)=6.3×10-2mol•L-1.
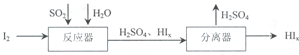
(4)SO2是大气污染物,若用KMnO4作脱硫剂,可使燃煤尾气中的SO2反应生成MnSO4,反应的离子方程式是2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.SO2还可以按下列流程制备化工原料硫酸,反应器中发生反应的化学方程式是SO2+xI2+2H2O=H2SO4+2HIx.

(1)已知:
2H2S(g)+3O2(g)═2SO2(g)+2H2O(g)△H=-1036.46kj.mol-1
S(s)+O2(g)═SO2(g)△H=-297.04kJ.mol-1
写出H2S(g)与O2(g)反应产生S(s)和H2O(g)的热化学方程式2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-442.38kJ.mol-1.
(2)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用离子方程式,从沉淀溶解平衡的角度表示由ZnS转变为CuS的过程ZnS(S)+Cu2+(aq)?Zn2+(aq)+CuS(S).
(3)某酸性FeSO4溶液中含有少量的SnSO4,为得到纯净的硫酸亚铁晶体(FeSO4•xH2O),可向溶液中通入H2S气体至饱和,然后用硫酸酸化至Ph=2,过滤后,将所得滤液蒸发浓缩,冷却结晶,过滤洗涤,得到硫酸亚铁晶体.查阅资料,得到相关物质的有关数据如下表:
| 25℃ | 饱和H2S溶液 | FeS | SnS | |
| pH | 3.9 | 3.0(开始沉淀 | 5.5(沉淀完全) | 1.6(沉淀完全) |
| Ksp | 6.3×10-18 | 1.0×10-25 | ||
②在SnS、FeS共存的溶液中,若c(Sn2+)=1.0×10-9mol•L-1,则c(Fe2+)=6.3×10-2mol•L-1.
(4)SO2是大气污染物,若用KMnO4作脱硫剂,可使燃煤尾气中的SO2反应生成MnSO4,反应的离子方程式是2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+.SO2还可以按下列流程制备化工原料硫酸,反应器中发生反应的化学方程式是SO2+xI2+2H2O=H2SO4+2HIx.

10.设NA为阿佛加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4L空气中O2、N2分子数为NA | |
| B. | 0.1mol羟基中所含电子数目为NA | |
| C. | 钠与氧气反应时,每消耗4.6g钠时生成的阴离子数目为0.1NA | |
| D. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数为0.2NA |
7.下列关于NaHCO3溶液的叙述正确的是( )
| A. | NaHCO3溶液显弱酸性 | |
| B. | 该溶液中K+、Al3+、H+、SO${\;}_{4}^{2-}$可以大量共存 | |
| C. | 加水稀释该溶液,溶液中$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| D. | 向该溶液中加入足量的氢氧化钙溶液的离子方程式为:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O |
8.下列说法正确的是( )
| A. | 按系统命名法 的名称为3,3-二甲基-2-乙基戊烷 的名称为3,3-二甲基-2-乙基戊烷 | |
| B. | 乙烯、乙炔是较活泼的有机物,能发生氧化反应,甲烷和苯性质较稳定,不能发生氧化反应 | |
| C. | 分子式为C5H12O的醇共有8种,其中能催化氧化成醛的同分异构体有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |



