题目内容
8.下列有关性质的比较,不能用元素周期律解释的是( )| A. | 热稳定性H2O>H2S | B. | 还原性Ⅰ->Br->Cl- | ||
| C. | 金属性 K>Na | D. | 酸性 HCl>HF |
分析 A.非金属性越强,氢化物越稳定;
B.非金属性越强,对应离子的还原性越弱;
C.同主族,从上到下金属性增强;
D.非金属性F>Cl,但HF为弱酸.
解答 解:A.非金属性O>S,则热稳定性H2O>H2S,能用元素周期律解释,故A正确;
B.非金属性Cl>Br>I,则还原性Ⅰ->Br->Cl-,能用元素周期律解释,故B正确;
C.同主族,从上到下金属性增强,则金属性 K>Na,能用元素周期律解释,故C正确;
D.非金属性F>Cl,但HF为弱酸,HCl为强酸,不能用元素周期律解释,故D错误;
故选D.
点评 本题考查元素的性质及元素周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
18.在pH=1无色溶液中,能大量共存的离子组是( )
| A. | Cu2+、Cl-、Mg2+、NO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | HCO3-、NH4+、Ag+、NO3- |
16.海水中主要离子的含量如下:
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示)HCO3-+H2O?H2CO3+OH-.
(2)电渗析法淡化海水示意图如图1所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有Mg(OH)2和CaCO3,生成CaCO3的离子方程式是Ca2++OH-+HCO3-=CaCO3↓+H2O.
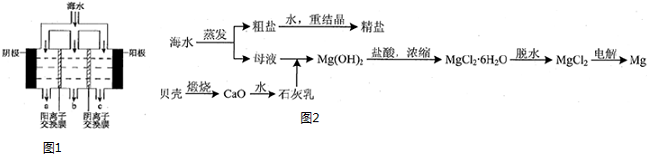
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如图2所示:
在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是bd.
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L.
①饱和Mg(OH)2溶液中滴加酚酞,现象是溶液变红.
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量盐酸,再加入足量NaOH,将Mg2+转为Mg(OH)2.25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比较,结果偏小.[填“偏大”、“偏小”或“相等”,海水中饱和Mg(OH)2溶液的密度都以lg/cm3计].
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
(2)电渗析法淡化海水示意图如图1所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有Mg(OH)2和CaCO3,生成CaCO3的离子方程式是Ca2++OH-+HCO3-=CaCO3↓+H2O.

(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如图2所示:
在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是bd.
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L.
①饱和Mg(OH)2溶液中滴加酚酞,现象是溶液变红.
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量盐酸,再加入足量NaOH,将Mg2+转为Mg(OH)2.25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比较,结果偏小.[填“偏大”、“偏小”或“相等”,海水中饱和Mg(OH)2溶液的密度都以lg/cm3计].
3.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,64 g SO2含有的原子数目为NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 mol镁与足量稀硫酸反应时失去的电子数目为2 NA | |
| D. | 1 mol•L-1K2SO4溶液中含有的钾离子数目为2 NA |
13.中国丝绸有五千年的历史和文化.古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮.这种“碱剂”可能是( )
| A. | 食盐 | B. | 火碱 | C. | 草木灰 | D. | 胆矾 |
20.短周期元素X、Y、Z、W原子序数依次增大,Y、Z、W的最高价氧化物对应水化物间可两两反应生成盐和水;化合物YWX是漂白液的有效成分.下列说法正确的是( )
| A. | Z单质还原性大于Y单质 | |
| B. | X的氢化物沸点高于W的氢化物 | |
| C. | 仅含X、Y两元素的化合物均只含离子键 | |
| D. | 上述四种元素形成的简单离子中,X离子半径最小 |
17.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在常温常压下,2.24LSO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,20gD20分子中所含中子数为10NA |
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.