题目内容
铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜板腐蚀剂.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 .腐蚀铜板后的混合溶液中,若Cu2+、Fe3+的浓度均为0.10mol?L-1,不考虑溶液体积的变化,则原FeCl3溶液的浓度为 .
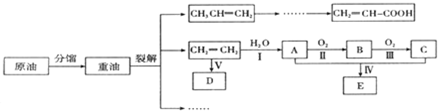
(2)某化学小组在实验室按照下列操作分离腐蚀铜板后的混合液并制取有关物质,图示如下:

请回答下列问题:
①试剂X为 ;试剂Y为 ;操作M为 .
②固体c的化学式为 .
③检验混合溶液B中是否存Fe3+的操作是 .C中反应的总的化学方程式为 .
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
(2)某化学小组在实验室按照下列操作分离腐蚀铜板后的混合液并制取有关物质,图示如下:

请回答下列问题:
①试剂X为
②固体c的化学式为
③检验混合溶液B中是否存Fe3+的操作是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)铜和氯化铁发生氧化还原反应生成氯化铜、氯化亚铁;根据Cu2+、Fe3+的浓度均为0.10mol?L-1结合方程式进行计算;
(2)混合液A加入过量的铁,则铁将铜置换出来,将三价铁还原成二价铁离子,所以过滤得固体a为铜和过量的铁,溶液B为二价铁溶液,加入氢氧化钠先生成氢氧化亚铁,在空气中放置氢氧化亚铁被氧化成氢氧化铁,所以最终生成氢氧化铁的沉淀c;固体a为铜和过量的铁再加入稀盐酸溶解单质铁,再过滤的固体b为铜,与试剂Y加热反应生成蓝色溶液,所以Y为浓硫酸,蓝色溶液为硫酸铜,再经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥得蓝色晶体,以此分析解答.
(2)混合液A加入过量的铁,则铁将铜置换出来,将三价铁还原成二价铁离子,所以过滤得固体a为铜和过量的铁,溶液B为二价铁溶液,加入氢氧化钠先生成氢氧化亚铁,在空气中放置氢氧化亚铁被氧化成氢氧化铁,所以最终生成氢氧化铁的沉淀c;固体a为铜和过量的铁再加入稀盐酸溶解单质铁,再过滤的固体b为铜,与试剂Y加热反应生成蓝色溶液,所以Y为浓硫酸,蓝色溶液为硫酸铜,再经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥得蓝色晶体,以此分析解答.
解答:
解:(1)铜和氯化铁发生氧化还原反应生成氯化铜、氯化亚铁,离子方程式为2Fe3++Cu=2Fe2++Cu2+,此时Cu2+的浓度均为0.10mol?L-1,所以消耗的三价铁离子浓度为0.20mol?L-1,又最终还剩0.10mol?L-1Fe3+,所以原FeCl3溶液的浓度为0.2+0.1=0.3mol?L-1,
故答案为:2Fe3++Cu=2Fe2++Cu2+;0.3mol?L-1;
(2)混合液A加入过量的铁,则铁将铜置换出来,将三价铁还原成二价铁离子,所以过滤得固体a为铜和过量的铁,溶液B为二价铁溶液,加入氢氧化钠先生成氢氧化亚铁,在空气中放置氢氧化亚铁被氧化成氢氧化铁,所以最终生成氢氧化铁的沉淀c;固体a为铜和过量的铁再加入稀盐酸溶解单质铁,再过滤的固体b为铜,与试剂Y加热反应生成蓝色溶液,所以Y为浓硫酸,蓝色溶液为硫酸铜,再经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥得蓝色晶体;
①根据以上分析,试剂X为稀盐酸;试剂Y为浓硫酸,操作M为蒸发浓缩、冷却结晶,过滤、洗涤、干燥,故答案为:稀盐酸;浓硫酸;蒸发浓缩、冷却结晶;
②根据以上分析,固体c的化学式为Fe(OH)3,故答案为:Fe(OH)3;
③取少量溶液于试管中,用胶头滴管加入 KSCN溶液,若变红则有三价铁,否则无三价铁;加入氢氧化钠先生成氢氧化亚铁,在空气中放置,氢氧化亚铁在空气被氧化,氢氧化亚铁被氧化成氢氧化铁,反应的化学方程式是为:4Fe(OH)2+2H2O+O2═4Fe(OH)3,
故答案为:取少量溶液于试管中,用胶头滴管加入 KSCN溶液,若变红则有三价铁,否则无三价铁;4Fe(OH)2+2H2O+O2═4Fe(OH)3.
故答案为:2Fe3++Cu=2Fe2++Cu2+;0.3mol?L-1;
(2)混合液A加入过量的铁,则铁将铜置换出来,将三价铁还原成二价铁离子,所以过滤得固体a为铜和过量的铁,溶液B为二价铁溶液,加入氢氧化钠先生成氢氧化亚铁,在空气中放置氢氧化亚铁被氧化成氢氧化铁,所以最终生成氢氧化铁的沉淀c;固体a为铜和过量的铁再加入稀盐酸溶解单质铁,再过滤的固体b为铜,与试剂Y加热反应生成蓝色溶液,所以Y为浓硫酸,蓝色溶液为硫酸铜,再经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥得蓝色晶体;
①根据以上分析,试剂X为稀盐酸;试剂Y为浓硫酸,操作M为蒸发浓缩、冷却结晶,过滤、洗涤、干燥,故答案为:稀盐酸;浓硫酸;蒸发浓缩、冷却结晶;
②根据以上分析,固体c的化学式为Fe(OH)3,故答案为:Fe(OH)3;
③取少量溶液于试管中,用胶头滴管加入 KSCN溶液,若变红则有三价铁,否则无三价铁;加入氢氧化钠先生成氢氧化亚铁,在空气中放置,氢氧化亚铁在空气被氧化,氢氧化亚铁被氧化成氢氧化铁,反应的化学方程式是为:4Fe(OH)2+2H2O+O2═4Fe(OH)3,
故答案为:取少量溶液于试管中,用胶头滴管加入 KSCN溶液,若变红则有三价铁,否则无三价铁;4Fe(OH)2+2H2O+O2═4Fe(OH)3.
点评:本题考查了铁盐、亚铁盐的性质,题目难度不大,注意不同价态铁元素之间的转化是高考的热点,注意相关知识的积累.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
常温下pH为2的盐酸,下列叙述正确的是( )
| A、将10 mL该溶液稀释至100 mL后,pH小于3 |
| B、向该溶液中加入等体积pH为12的氨水恰好完全中和 |
| C、该溶液中盐酸电离出的c (H+)与水电离出的c (H+)之比为1010:l |
| D、该溶液中由水电离出的c(H+)水×c (OH-)水=1×10-14 |
关于化学反应的自发性,下列说法正确的是( )
| A、凡是放热反应都是自发的,由于吸热反应都是非自发的 |
| B、自发反应一定是熵增大,非自发反应一定是熵减少或不变 |
| C、自发的氧化还原反应的化学能可以转变为电能 |
| D、自发反应在任意条件下均能实现 |
同温同压下,等质量的下列气体所占有的体积最大的是( )
| A、H2 |
| B、N2 |
| C、SO2 |
| D、Cl2 |
 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答: