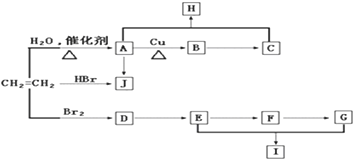
题目内容
 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.请回答:(1)元素C在周期表中的位置是
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式为
(3)D和E两种元素相比较,其原子得电子能力较强的是
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有四种元素),这两种酸式盐在水溶液中反应的离子方程式是
(5)已知常温下1g A单质在D单质中燃烧生成稳定的液态物质时放出142.9kJ热量,则表示A单质燃烧热的热化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A元素的原子半径最小,则A为氢元素,B元素原子的最外层电子数是内层电子数的2倍,则B为碳元素,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,则C为氮元素,D与E同主族,E元素原子的最外层电子数比次外层电子数少2,则D为氧元素,E为硫元素,因为F为短周期元素,原子序数大于硫,所以F为氯元素,据此答题.
解答:
解:A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,A元素的原子半径最小,则A为氢元素,B元素原子的最外层电子数是内层电子数的2倍,则B为碳元素,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,则C为氮元素,D与E同主族,E元素原子的最外层电子数比次外层电子数少2,则D为氧元素,E为硫元素,因为F为短周期元素,原子序数大于硫,所以F为氯元素,
(1)C为氮元素,在周期表中第二周期第ⅤA族,B为碳元素,原子结构示意图为 ,
,
故答案为:第二周期第ⅤA族; ;
;
(2)元素D的单质与金属钠反应生成的化合物为过氧化钠,它与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(3)O和S两种元素相比较,其原子得电子能力较强的是氧,要证明这一结论,
a.单质的沸点与得电子能力 无关,故错误;
b.二者形成的化合物中,O元素的原子显负价,说明氧得电子能力强,故正确;
c.得电子能力越强,气态氢化物越稳定,故正确;
d.氢化物的水溶液的酸性不能说明得电子能力,故错误;
故选bc;
(4)元素A、D、E与钠元素可形成两种酸式盐为硫酸氢钠和亚硫酸氢钠,这两种酸式盐在水溶液中反应的离子方程式是H++HSO3-═SO2↑+H2O,
故答案为:H++HSO3-═SO2↑+H2O;
(5)1g氢气燃烧生成液态水放出142.9kJ热量,1mol氢气2g完全反应生成液态水放热为285.5KJ,则表示氢气燃烧热的热化学方程式为:H2(g)+
O2(g)=H2O(l)△H=-285.8KJ/mol,
故答案为:H2(g)+
O2(g)=H2O(l)△H=-285.8KJ/mol.
(1)C为氮元素,在周期表中第二周期第ⅤA族,B为碳元素,原子结构示意图为
 ,
,故答案为:第二周期第ⅤA族;
 ;
; (2)元素D的单质与金属钠反应生成的化合物为过氧化钠,它与水反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(3)O和S两种元素相比较,其原子得电子能力较强的是氧,要证明这一结论,
a.单质的沸点与得电子能力 无关,故错误;
b.二者形成的化合物中,O元素的原子显负价,说明氧得电子能力强,故正确;
c.得电子能力越强,气态氢化物越稳定,故正确;
d.氢化物的水溶液的酸性不能说明得电子能力,故错误;
故选bc;
(4)元素A、D、E与钠元素可形成两种酸式盐为硫酸氢钠和亚硫酸氢钠,这两种酸式盐在水溶液中反应的离子方程式是H++HSO3-═SO2↑+H2O,
故答案为:H++HSO3-═SO2↑+H2O;
(5)1g氢气燃烧生成液态水放出142.9kJ热量,1mol氢气2g完全反应生成液态水放热为285.5KJ,则表示氢气燃烧热的热化学方程式为:H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
点评:本题主要考查了原子结构示意图、离子方程式、元素周期律、热化学方程式,内容较多,中等难度,元素推断是解题关键,解题要注意基础知识的灵活运用.

练习册系列答案
相关题目
已知:2CO (g)+O2 (g)═2CO2 (g);△H1=-566kJ?mol-1 Na2O2(s)+CO2(g)=Na2CO3(g)+O2(g);△H2=-226kJ?mol-1 根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为283kJ |
| B、2Na2O2(s)+2CO2(s)=2Na2CO3(g)+2O2(g);△H3>-452kJ?mol-1 |
C、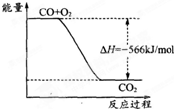 如图可表示由CO生成CO2的反应过程和能量关系 |
| D、CO(g)与Na2O2 (s)反应放出509kJ热量时,电子转移数约为6.02×1023 |
下列变化:①导电、②爆炸、③缓慢氧化、④变色、⑤无水硫酸铜吸水、⑥工业制氧气、⑦白磷变成红磷、⑧久置浓HNO3变黄,一定属于化学变化的是( )
| A、①④ | B、⑥⑧ |
| C、②⑥⑦ | D、③⑤⑦⑧ |
短周期元素Q、W、X、Y、Z的原子序数依次增大,X元素的颜色反应呈黄色,Q原子的最外层电子数是其内层电子数的2倍,W、Z原子的最外层电子数相同,Z元素的核电荷数是W的2倍,Y是地壳中含量最多的金属元素.下列说法不正确的是( )
| A、工业上常用电解的方法制备X、Y的单质 |
| B、元素Q和Z能形成QZ2型的共价化合物 |
| C、原子半径的大小顺序:r(X)>r(Y)>r(W)>r(Q) |
| D、元素X、Y的最高价氧化物对应的水化物之间能发生反应 |