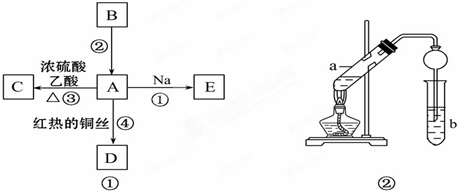
题目内容
同温同压下,等质量的下列气体所占有的体积最大的是( )
| A、H2 |
| B、N2 |
| C、SO2 |
| D、Cl2 |
考点:摩尔质量
专题:
分析:根据阿伏加德罗定律可知,气体的物质的量越多,则气体的体积越大,根据气体的质量和摩尔质量计算气体的物质的量,进而比较体积大小.
解答:
解:假设气体的质量都为mg,则气体的物质的量分别为:
n(H2)=
mol,
n(N2)=
mol,
n(SO2)=
mol,
n(Cl2)=
mol,
根据阿伏加德罗定律可知,同温同压下,气体的物质的量越多,则气体的体积越大,
所以物质的量最多的是H2,体积最大的就是H2,
故选A.
n(H2)=
| m |
| 2 |
n(N2)=
| m |
| 28 |
n(SO2)=
| m |
| 64 |
n(Cl2)=
| m |
| 71 |
根据阿伏加德罗定律可知,同温同压下,气体的物质的量越多,则气体的体积越大,
所以物质的量最多的是H2,体积最大的就是H2,
故选A.
点评:本题考查阿伏加德罗定律定律及推论,难度不大.注意同温同压下,气体的物质的量越多,则气体的体积越大.

练习册系列答案
相关题目
在水溶液中能大量共存的一组离子是( )
| A、HCO3-、H+、NO3-、Na+ |
| B、Na+、Cu2+、OH-、SO42- |
| C、Mg2+、H+、OH-、SO42- |
| D、NH4+、K+、Br-、NO3- |
已知:2CO (g)+O2 (g)═2CO2 (g);△H1=-566kJ?mol-1 Na2O2(s)+CO2(g)=Na2CO3(g)+O2(g);△H2=-226kJ?mol-1 根据以上热化学方程式判断,下列说法正确的是( )
| A、CO的燃烧热为283kJ |
| B、2Na2O2(s)+2CO2(s)=2Na2CO3(g)+2O2(g);△H3>-452kJ?mol-1 |
C、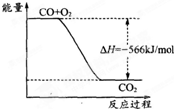 如图可表示由CO生成CO2的反应过程和能量关系 |
| D、CO(g)与Na2O2 (s)反应放出509kJ热量时,电子转移数约为6.02×1023 |
下列不存在丁达尔效应的分散系是( )
| A、有尘埃的空气 |
| B、氢氧化铝胶体 |
| C、CuSO4溶液 |
| D、向沸水中滴入FeCl3饱和溶液所得液体 |
下列变化:①导电、②爆炸、③缓慢氧化、④变色、⑤无水硫酸铜吸水、⑥工业制氧气、⑦白磷变成红磷、⑧久置浓HNO3变黄,一定属于化学变化的是( )
| A、①④ | B、⑥⑧ |
| C、②⑥⑦ | D、③⑤⑦⑧ |