题目内容
5.长式周期表共有18个纵行,从左到右排为1-18列,碱金属为第一列,稀有气体元素为第18 列.按这种规定,下列说法正确的是( )| A. | 第六周期共包含18种元素 | |
| B. | 只有第二列的元素原子最外层电子排布为ns2 | |
| C. | 第四周期第8列是铁元素 | |
| D. | 第10、11列为ds区 |
分析 A、第六周期含锕系元素,ⅢB中含锕系元素,则六周期中都含有32种元素;
B.氦原子及一些过渡元素原子最外层电子排布也为ns2;
C.第四周期第8列元素是铁元素;
D.第11、12列为ⅠB、ⅡB族,属于ds区.
解答 解:A、第六周期含锕系元素,ⅢB中含锕系元素,则六周期中都含有32种元素,而不是18种元素,故A错误;
B.氦原子及一些过渡元素原子最外层电子排布也为ns2,故B错误;
C.铁元素处于第四周期第8列,故C正确;
D.第11、12列为ⅠB、ⅡB族,属于ds区,第10列属于Ⅷ族,故D错误;
故选:C.
点评 本题考查元素周期表的结构,难度不大,注意整体把握元素周期表.

练习册系列答案
相关题目
14.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在,Na+可能存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
16.纤维分天然纤维和化学纤维,化学纤维又可分为合成纤维和人造纤维,下列材料中,主要成分属于合成纤维的是( )
①纯棉②涤纶③人造羊毛④黏胶纤维⑤醋酸纤维⑥羊毛.
①纯棉②涤纶③人造羊毛④黏胶纤维⑤醋酸纤维⑥羊毛.
| A. | ①②⑥ | B. | ③⑥ | C. | ②③ | D. | ①②③④⑤⑥ |
13.下列物质的分子或晶体中包含正四面体结构,且键角不等于109o28’的是( )
| A. | 白磷 | B. | 金刚石 | C. | 氨气 | D. | 甲烷 |
10.化学与人类生活、生产和社会可持续发展密切相关.下列说法正确的是( )
| A. | 往自来水中加入明矾进行杀菌消毒 | |
| B. | 氮化硅陶瓷是一种新型的无机非金属材料 | |
| C. | 在食品袋中放入硅胶、生石灰的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 为提高农作物的产量和质量,应大量使用化肥和农药 |
17.(Ⅰ)部分弱酸的电离平衡常数如表:
(1)室温下①0.1mol•L-1 HCOONa,②0.1mol•L-1 NaClO,③0.1mol•L-1 Na2CO3,④0.1mol•L-1 NaHCO3溶液的pH由大到小的关系为③②④①.
(2)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-).
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式ClO-+CO2+H2O=HCO3-+HClO.
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为c(HCOO-)>c(Na+)>c(H+)>c(OH-).
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液.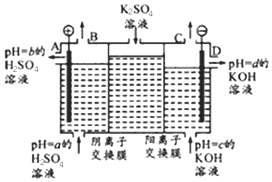
①该电解槽中通过阴离子交换膜的离子数<(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为b<a<c<d;
③电解一段时间后,B出口与C出口产生气体的质量比为8:1.
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-).
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式ClO-+CO2+H2O=HCO3-+HClO.
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为c(HCOO-)>c(Na+)>c(H+)>c(OH-).
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液.

①该电解槽中通过阴离子交换膜的离子数<(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为b<a<c<d;
③电解一段时间后,B出口与C出口产生气体的质量比为8:1.
14.下列各组物质气化或熔化时,所克服的微粒间的作用力,属同种类型的是( )
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 金刚石和氯化钾的熔化 |