题目内容
20.在实验室里制取乙烯时,常因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2、CO2、水蒸气和炭黑.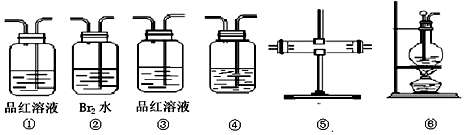
(1)写出实验室制取乙烯的化学方程式:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)用编号为①→⑥的实验装置设计一个实验,以验证上述混合气体中含有CO2、SO2和水蒸气.正确连接装置的顺序是(按产物气流从左到右的流向):⑥→⑤→①→②→③→④.
(3)装置⑤中的固体药品为无水CuSO4,用以验证的产物是H2O,现象是白色粉末变蓝色;
(4)装置①中的现象是品红溶液褪色,验证的气体是SO2;
(5)装置②中溴水的作用是吸收SO2,写出该装置中发生反应的化学反应方程式:Br2+SO2+2H2O=2HBr+H2SO4
装置②中溴水能(填“能”或“不能”)换成酸性高锰酸钾溶液,若不能替换,说明原因(若能替换不需说明)、.
(6)若装置③中品红溶液不褪色,可得到结论为二氧化硫已经除尽;此时盛有澄清石灰水的装置④中出现浑浊现象,可以验证二氧化碳气体的存在.
分析 (1)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,发生分子内脱水生成乙烯和水;
(2)多种产物需检验时,应考虑先后顺序,检验二氧化硫用品红溶液,检验二氧化碳用澄清的石灰水,检验水蒸气用无水硫酸铜,因溶液中有水,所以首先检验水蒸气;因为CO2是用澄清石灰水来检验的,而SO2也可以使澄清石灰水变浑,二氧化硫能使品红褪色,二氧化碳不能,所以,检验二氧化硫在检验二氧化碳之前,再通过澄清石灰水确认CO2存在;
(3)无水硫酸铜和水作用,白色变蓝色,检验水蒸气;
(4)实验的装置①中装的是品红溶液,当混合气体通过①瓶时,品红褪色,说明产物中有二氧化硫;
(5)装置②中的溴水能和二氧化硫反应,用于吸收二氧化硫,发生氧化还原反应生成硫酸、氢溴酸;二氧化硫与高锰酸钾反应无气体生成,装置②中溴水能换成酸性高锰酸钾溶液;
(6)装置③由于检验混合气体中的二氧化硫已经除尽,装置④用于检验二氧化碳,若装置③品红溶液不褪色,装置④中澄清石灰水变浑浊,则证明混合气体中含有二氧化碳.
解答 解:(1)实验室制备乙烯利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,化学方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)实验室制乙烯选用装置⑥;同时乙醇跟浓H2SO4温度过高反应,CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,因溶液中有水,所以必须先检验水蒸气,选用装置⑤,放入无水硫酸铜,变蓝则说明有水生成;因二氧化碳和二氧化硫都能使澄清的石灰水变浑浊,二氧化硫能使品红褪色,二氧化碳不能,所以用装置①,装置中品红褪色,则说明有SO2气体产生,②装置吸收SO2,③装置品红不褪色,说明吸收完全;最后用装置④,通过澄清石灰水变浑浊,确认CO2存在,
故答案为:⑤②③④;
(3)装置⑤的作用是检验水蒸气,用白色的无水硫酸铜粉末,CuSO4+5H2O═CuSO4•5H2O变蓝说明混合气体中有水蒸气,
故答案为:无水CuSO4;H2O;白色粉末变蓝色;
(4)装置①盛有品红溶液,用于检验混合气体中含有SO2,品红溶液褪色,证明混合气体中含有二氧化硫,
故答案为:品红溶液褪色;SO2;
(5)溴水能够与二氧化硫发生氧化还原反应生成硫酸、氢溴酸,Br2+SO2+2H2O=2HBr+H2SO4,从而除去混合气体中的二氧化硫,所以装置②的作用是吸收SO2,装置②中溴水能换成酸性高锰酸钾溶液,因二氧化硫与高锰酸钾反应5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4无气体生成,对后续检验无干扰,
故答案为:吸收SO2;Br2+SO2+2H2O=2HBr+H2SO4;能;
(6)装置③用于检验混合气体中的二氧化硫是否除尽,若装置③中二氧化硫不褪色,证明二氧化硫已经除尽;然后将混合气体通入盛有澄清石灰水的装置④,若澄清石灰水变浑浊,则证明混合气体中含有CO2,
故答案为:二氧化硫已经除尽;澄清石灰水;浑浊现象;二氧化碳.
点评 本题考查了乙醇跟浓硫酸反应生成二氧化硫、二氧化碳、水蒸气和炭黑产物的检验,注意当有多种产物需检验时,应考虑先后顺序,二氧化碳和二氧化硫都能使澄清的石灰水变浑浊,二氧化硫能使品红褪色,二氧化碳不能是解答本题的关键,题目难度中等.

| A. | 在常温常压下,C4H10是液体 | |
| B. | 丁烷有正丁烷与异丁烷两种同分异构体 | |
| C. | C4H10与C9H20互为同系物 | |
| D. | C4H10进行一氯取代后共生成两种沸点不同的产物 |
| A. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| B. | 在含有等物质的量的OH-、CO32-、SO32-的溶液中加入稀盐酸:OH-、SO32-、CO32- | |
| C. | 在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ | |
| D. | 在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH溶液:H+、Al3+、Al(OH)3 |
| A. | 第六周期共包含18种元素 | |
| B. | 只有第二列的元素原子最外层电子排布为ns2 | |
| C. | 第四周期第8列是铁元素 | |
| D. | 第10、11列为ds区 |
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(1)═H2O(g),△H=+44.0kJ•mol-l 则甲烷的燃烧热为( )
| A. | 846.3 kJ•mol-l | B. | 758.3 kJ•mol-l | C. | 890.3 kJ•mol-l | D. | 714.3 kJ•mol-l |
| A. | 体现浓硫酸的吸水性 | |
| B. | 体现了浓硫酸的脱水性 | |
| C. | 体现了浓硫酸的吸水性和脱水性 | |
| D. | 体现了浓硫酸的吸水性、脱水性和强氧化性 |
| A. | 强度高、弹性好 | B. | 良好的导电、导热性 | ||
| C. | 耐磨、耐化学腐蚀 | D. | 不怕虫蛀 |
