题目内容
17.(Ⅰ)部分弱酸的电离平衡常数如表:| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)浓度均为0.1mol•L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-).
(3)少量CO2通入到过量的NaClO溶液中发生反应的离子方程式ClO-+CO2+H2O=HCO3-+HClO.
(4)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为c(HCOO-)>c(Na+)>c(H+)>c(OH-).
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液.
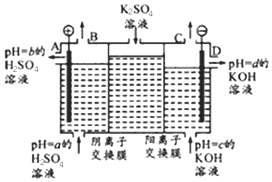
①该电解槽中通过阴离子交换膜的离子数<(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为b<a<c<d;
③电解一段时间后,B出口与C出口产生气体的质量比为8:1.
分析 (Ⅰ)(1)酸性越弱对应形成的盐的水解能力越强,碱性越强;
(2)酸的电离常数越大,酸性越强,其盐的水解程度越小;水解程度越大,溶液中酸根离子浓度越小;
(3)根据强酸制取弱酸判断,H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-;
(4)甲酸为弱电解质,pH=3的甲酸和pH=11的氢氧化钠溶液等体积混合,甲酸过量,溶液呈酸性,据此回答;
(Ⅱ)①电解硫酸钾溶液,阳极发生氧化反应,OH-被氧化生成O2;SO42-通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动;
②OH-被氧化,阳极生成H+和O2,pH减小,阴极发生还原反应生成H2和OH-,pH增大;
③B口生成氧气,C生成氢气.
解答 解:(Ⅰ)(1)图表中比较得到酸性强弱H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-,对应盐水解程度HSO3-<HCOO-<SO32-<HCO3-<ClO-<CO32-,室温下①0.1mol•L-1 HCOONa,②0.1mol•L-1 NaClO,③0.1mol•L-1 Na2CO3,④0.1mol•L-1 NaHCO3溶液的pH由大到小的关系为:③②④①,
故答案为:③②④①;
(2)水解程度越大,溶液中酸根离子浓度越小,水解程度:CO32->SO32-,则溶液中离子浓度:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-),
故答案为:c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-);
(3)根据强酸制取弱酸知,H2SO3>HCOOH>HSO3->H2CO3>HClO>HCO3-,少量CO2通入到过量的NaClO溶液中生成次氯酸和碳酸氢钠,离子方程式为:ClO-+CO2+H2O=HCO3-+HClO,故答案为:ClO-+CO2+H2O=HCO3-+HClO;
(4)甲酸为弱电解质,pH=3的甲酸和pH=11的氢氧化钠溶液等体积混合,甲酸过量,溶液呈酸性,则c(H+)>c(OH-),溶液中存在:c(HCOO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)<c(HCOO-),离子浓度顺序是:c(HCOO-)>c(Na+)>c(H+)>c(OH-).
故答案为:c(HCOO-)>c(Na+)>c(H+)>c(OH-);
(Ⅱ)①电解硫酸钾溶液,阳极发生氧化反应,OH-被氧化生成O2,SO42-通过阴离子交换膜向阳极移动,钾离子通过阳离子交换膜向阴极移动,由电荷守恒知钾离子数目大于硫酸根离子数目,
故答案为:<;
②阳极上阴离子OH-被氧化,pH减小,阴极阳离子氢离子发生还原反应生成H2和OH-,pH增大,则pH为b<a<c<d,故答案为:b<a<c<d;
③B口生成氧气,C生成氢气,物质的量之比为1:2,则质量之比为32:4=8:1,
故答案为:8:1.
点评 本题考查了盐类水解、弱电解质的电离、电解原理等知识点,根据弱电解质电离特点、盐类水解特点、电极反应的特点来分析解答即可,注意把握电离常数与酸性强弱的关系,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 甲、乙两杯溶液的物质的量浓度之间的关系为c(甲)=10c(乙) | |
| B. | 甲溶液中醋酸的电离程度小 | |
| C. | 中和等物质的量的NaOH,需要乙的体积是甲的10倍 | |
| D. | 甲乙等体积,与足量锌反应时,乙产生氢气的物质的量大 |
| A. | 第六周期共包含18种元素 | |
| B. | 只有第二列的元素原子最外层电子排布为ns2 | |
| C. | 第四周期第8列是铁元素 | |
| D. | 第10、11列为ds区 |
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(1)═H2O(g),△H=+44.0kJ•mol-l 则甲烷的燃烧热为( )
| A. | 846.3 kJ•mol-l | B. | 758.3 kJ•mol-l | C. | 890.3 kJ•mol-l | D. | 714.3 kJ•mol-l |
| A. | $\frac{r({F}^{-})}{r(M{g}^{2+})}$ | B. | $\frac{r(N{a}^{+})}{r(M{g}^{2+})}$ | C. | $\frac{r(Cl)}{r(C{l}^{-})}$ | D. | $\frac{r(Na)}{r(N{a}^{+})}$ |
| A. | 体现浓硫酸的吸水性 | |
| B. | 体现了浓硫酸的脱水性 | |
| C. | 体现了浓硫酸的吸水性和脱水性 | |
| D. | 体现了浓硫酸的吸水性、脱水性和强氧化性 |
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 蒸馏实验时向蒸馏瓶中放入几粒沸石(或碎瓷片) | |
| C. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| D. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 |
| 编号 | 实验内容 | 实验目的 |
| A | 测定相同物质的量浓度的KOH和氨水的pH | 证明氨水中存在电离平衡 |
| B | 向混有NaCl的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| C | 将Mg、Al和NaOH溶液设计为原电池 | 比较Mg、Al活泼性强弱 |
| D | 用惰性电极电解饱和食盐水,阴极附近滴加酚酞 | 验证阴极有碱生成 |
| A. | A | B. | B | C. | C | D. | D |
