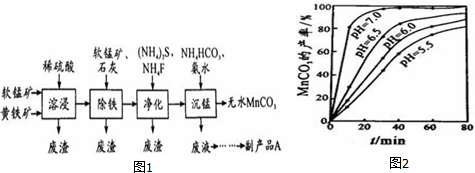
题目内容
1.聚合硫酸铁(简称PFS,化学式为[Fe(OH)n(SO4)(3-n)/2]m)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.现用一定质量的铁的氧化物(如图)为原料来制取聚合硫酸铁,实验步骤如图: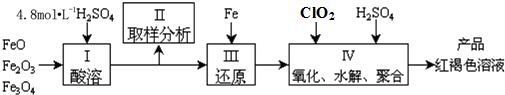
(1)实验室用18.4mol•L-1的浓硫酸配制250mL4.8mol•L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需的玻璃仪器:250mL容量瓶、胶头滴管
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是AC
A.确定下一步还原所需铁的量 B.控制溶液中Fe2+与Fe3+含量比
C.确定氧化Fe2+所需ClO2的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用ClO2氧化(还原产物为Cl-) 时的离子方程式_5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O
(4)为了分析产品聚合硫酸铁溶液中SO${\;}_{4}^{2-}$与Fe3+物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g.
(b)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,与0.1000mol/L VmL KMnO4酸性溶液恰好完全反应.
回答下列问题:
①根据(b)中步骤判断Cu2+、Fe2+、MnO${\;}_{4}^{-}$、Fe3+氧化性由强到弱的顺序MnO4->Fe3+>Cu2+>Fe2+
②聚合硫酸铁中SO${\;}_{4}^{2-}$与Fe3+的物质的量之比为$\frac{m}{233}$:$\frac{V}{200}$(用含m、V的代数式表示).
分析 (1)实验室用18.4mol•L-1的浓硫酸配制250mL4.8mol•L-1的硫酸溶液,所需的玻璃仪器有量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管;
(2)控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被ClO2氧化为Fe3+;
(3)酸性条件下,ClO2将Fe2+氧化为Fe3+,ClO2被还原为Cl-;
(4)①氧化剂氧化性强于氧化产物氧化性;
②mg白色沉淀为BaSO4,由硫酸根守恒n(SO42-)=n(BaSO4),由原子守恒与电电子转移守恒可得关系式:5Fe3+~5Fe2+~MnO4-,根据关系式计算n(Fe3+).
解答 解:(1)实验室用18.4mol•L-1的浓硫酸配制250mL4.8mol•L-1的硫酸溶液,用量筒量取浓硫酸,在烧杯中溶解,并用玻璃棒搅拌,移入2500mL容量瓶,最后需要用胶头滴管定容,
故答案为:250mL容量瓶、胶头滴管;
(2)因为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+,所以确定下一步还原所需铁的量,然后Fe2+再被氧化Fe3+,需要确定氧化Fe2+所需ClO2的量,
故答案为:AC;
(3)酸性条件下,ClO2将Fe2+氧化为Fe3+,ClO2被还原为Cl-,反应离子方程式为:5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O,
故答案为:5Fe2++ClO2+4H+=5Fe3++Cl-+2H2O;
(4)①发生反应:Cu+2Fe3+=2Fe2++Cu2+,5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,氧化剂氧化性强于氧化产物氧化性,氧化性由强到弱的顺序:MnO4->Fe3+>Cu2+>Fe2+,
故答案为:MnO4->Fe3+>Cu2+>Fe2+;
②mg白色沉淀为BaSO4,由硫酸根守恒n(SO42-)=n(BaSO4)=$\frac{m}{233}$mol,由原子守恒与电电子转移守恒可得关系式:5Fe3+~5Fe2+~MnO4-,则n(Fe3+)=5n(MnO4-)=5×V×10-3L×0.1mol/L×$\frac{250mL}{25mL}$,
n(SO42-):n(Fe3+)=$\frac{m}{233}$mol:5×V×10-3L×0.1mol/L×$\frac{250mL}{25mL}$=$\frac{m}{233}$:$\frac{V}{200}$,
故答案为:$\frac{m}{233}$:$\frac{V}{200}$.
点评 本题以聚合硫酸铁的制备为载体,考查溶液配制、氧化还原反应配平、氧化性强弱比较、化学工艺流程等,是对学生综合能力的考查,难度中等.

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案| A. | 3n | B. | 3n+1 | C. | 2n | D. | 2n+1 |
| A. | 工业上用电解熔融氯化镁制单质镁 | |
| B. | 工业上用电解饱和食盐水制氯气 | |
| C. | 工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅 | |
| D. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 |
| A. | 烷烃 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 甲苯苯环上的一个氢原子被含4个碳原子的烷基取代,所得产物有12种 | |
| C. | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,其原理相同 | |
| D. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
| A. | 0.5mol•L-1CuCl2溶液含有3.01×1023个Cu2+ | |
| B. | 28g聚乙烯分子含有的碳原子数为 NA | |
| C. | 0.2mol PCl5分子中,键数目为NA | |
| D. | 标准状况下,3.36L H2O含有9.03×1023个H2O分子 |
实验名称:氯水的性质实验
实验目的:验证氯水:①有酸性,②有漂白性(氧化性),③存在Cl-
实验用品:主要仪器用品:试管、胶头滴管.
选用试剂:新制的饱和氯水、NaOH溶液、滴有酚酞的NaOH溶液,请添加其他必需试剂:品红溶液、硝酸银溶液、稀硝酸.
实验步骤:依次验证氯水的上述三项化学性质.
实验记录表:
| 步骤编号 | 操作过程 | 实验现象 | 实验结论 |
| ① | 氯水有酸性 | ||
| ② | 氯水有漂白性 | ||
| ③ | 氯水中存在Cl- |
| A. | HCO3-→CO2 | B. | MnO4-→Mn2+ | C. | FeO→Fe3O4 | D. | Cl-→Cl2 |