题目内容
10.下列变化中,需加入还原剂才能实现的是( )| A. | HCO3-→CO2 | B. | MnO4-→Mn2+ | C. | FeO→Fe3O4 | D. | Cl-→Cl2 |
分析 需加入还原剂才能实现,则选项中为氧化剂的还原反应,氧化剂中某元素的化合价降低,以此来解答.
解答 解:A.不存在元素的化合价变化,为非氧化还原反应,故A不选;
B.Mn元素的化合价降低,需要加还原剂实现,故B选;
C.Fe元素的化合价升高,需要加氧化剂实现,故C不选;
D.Cl元素的化合价升高,需要加氧化剂实现,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的理解及应用,题目难度不大.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
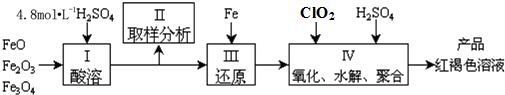
18.用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量红棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解A12O3的化学方程式是Al2O3+3H2SO4=2Al2(SO4)3+3H2O.
(2)KMnO4氧化Fe2+的离子方程式补充完整:
1MnO4-+5Fe2++8H+═1Mn2++5Fe3++4H2O
(3)已知:生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol•L-1
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量红棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2SO4溶解A12O3的化学方程式是Al2O3+3H2SO4=2Al2(SO4)3+3H2O.
(2)KMnO4氧化Fe2+的离子方程式补充完整:
1MnO4-+5Fe2++8H+═1Mn2++5Fe3++4H2O
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2.
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
5.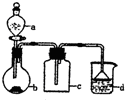 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是
( )
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是| 选项 | A中的物质 | b中的物质 | c中的物质 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO | H2O |
| D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
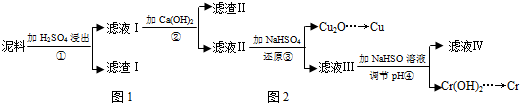
15.铜、铬都是用途广泛的金属.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如图:
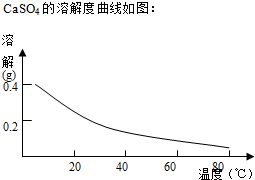
已知:部分物质沉淀的pH如表:
请回答下列问题:
(1)滤液I中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)当离子浓度≤1×10-5mol•L-1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.
(已知:Kap[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0;lg4=0.6)
(4)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.

已知:部分物质沉淀的pH如表:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |

请回答下列问题:
(1)滤液I中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)当离子浓度≤1×10-5mol•L-1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.
(已知:Kap[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0;lg4=0.6)
(4)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
2.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 纯水的电离方程式:H2O+H2O?H3O++OH- |
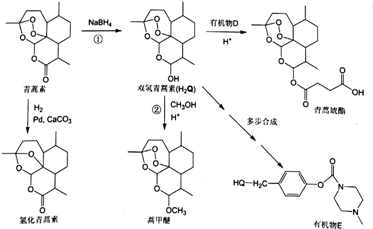
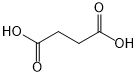 (或
(或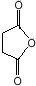 ).
). .
.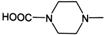 外,还需含苯环的二羟基化合物P,其结构简式为
外,还需含苯环的二羟基化合物P,其结构简式为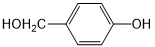 .化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式
.化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 (或
(或 ,其他合理答案亦可).
,其他合理答案亦可).