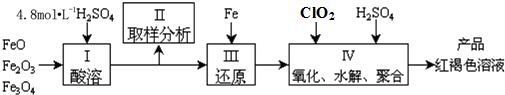
题目内容
11.下列各物质的转化关系如图所示,其中A是一种高熔点固体Al2 O3,D是一种棕红色固体.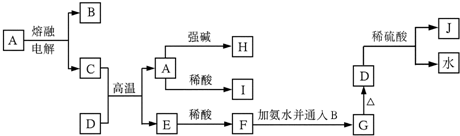
已知:2Al2 O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2回答下列问题:
(1)C的化学式为Al;J的化学式为Fe2(SO4)3.
(2)写出由A生成I的离子反应方程式:Al2O3+6H+=Al3++3H2O.
(3写出由C生成E的化学反应方程式:Fe2O3+2Al=$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 .
分析 D是一种红棕色固体,则可知,D为Fe2O3;A是一种高熔点固体Al2 O3,电解Al2O3时生成Al和O2,C能与氧化铁在高温下反应,则C为Al,B为O2,E为Fe,氧化铝与强碱反应生成H含有AlO2-,氧化铝与稀酸反应生成I含有Al3+,铁与稀酸反应生成F含有Fe2+,F与氨水及氧反应生成G为Fe(OH)3,G与硫酸反应生成J为Fe2(SO4)3,结合物质的性质和题目要求可解答该题.
解答 解:D是一种红棕色固体,则可知,D为Fe2O3;A是一种高熔点固体Al2 O3,电解Al2O3时生成Al和O2,C能与氧化铁在高温下反应,则C为Al,B为O2,E为Fe,氧化铝与强碱反应生成H含有AlO2-,氧化铝与稀酸反应生成I含有Al3+,铁与稀酸反应生成F含有Fe2+,F与氨水及氧反应生成G为Fe(OH)3,G与硫酸反应生成J为Fe2(SO4)3,
(1)根据上面的分析可知,C为Al,J为Fe2(SO4)3,
故答案为:Al;Fe2(SO4)3;
(2)由A生成I的离子反应方程式:Al2O3+6H+=Al3++3H2O,
故答案为:Al2O3+6H+=Al3++3H2O;
(3)C为Al,E为Fe,由C生成E的化学反应方程式为:Fe2O3+2Al=$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 ,
故答案为:Fe2O3+2Al=$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 .
点评 本题是一道典型的无机框图推断题,题目难度中等,本题不仅考查对元素化合物基础知识的掌握,还主要考查学科内知识间的综合推理能力,答题时注意根据物质的颜色和反应的条件进行推断.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
2.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 纯水的电离方程式:H2O+H2O?H3O++OH- |
6.下列各组混合物中,能用分液漏斗进行分离的是( )
| A. | 酒精和水 | B. | 碘和酒精 | C. | 水和CCl4 | D. | 汽油和植物油 |
16.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| B. | $\frac{K_W}{{c({H^+})}}$=10-13mol•L-1溶液中:NH4+、Mg2+、NO3-、SO32- | |
| C. | 通入大量CO2的溶液中:Na+、SO32-、CH3COO-、HCO3- | |
| D. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
1.下列实验操作中正确的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| C. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| D. | 蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |