题目内容
18. (1)CO2分子的电子式为
(1)CO2分子的电子式为 ;Na2O2的电子式为
;Na2O2的电子式为
(2)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是ad.(选填序号)
a.加水稀释 b.加入少量乙酸钠固体 c.通氯化氢 d.加入少量苛性钠固体
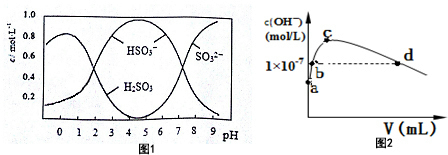
(3)葡萄酒中常用Na2S2O5做抗氧化剂.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图1所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式NO+NO2+2OH-=2NO2-+H2O.
(6)常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离产生的OH-离子浓度(c)的关系如图2所示
①c点溶液中离子浓度由大至小的关系是:c(Na+)>c(CO32-)>c(HCO3-).
②a点溶液中由水电离产生的c(H+)=1×10-10mol/L;b点溶液中c(H+)小于1×10-7mol/L(填写“等于”、“大于”或“小于”).
(7)部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25°C)) | Ki=1.77×10-14 | Ki=4.9×10-14 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
a.2HCOOH+CO32-═2HCOO-+H2O+CO2↑
b.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
c.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者.
分析 (1)CO2含有C=O键,为共价化合物;若是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
(2)电离程度增大,电离平衡应正向移动,且pH增大,则酸性减弱,以此来解答;
(3)根据图可知,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,据此书写水解方程式;
(4)根据Ksp[BaSO4]=c(Ba2+)•c(SO42-),可计算出需要放热c(Ba2+),进而计算最大浓度c(SO32-),据此答题;
(5)NaOH溶液完全吸收含等物质的量的NO、NO2混合气体,反应生成亚硝酸钠和水;
(6)①当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钠溶液,对水的电离起促进作用;
②水电离出的氢离子与氢氧根离子的浓度始终相等,a是没有通二氧化碳的情况,即pH=10的 NaOH溶液,结合水的离子常数分析求解;
b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×10-7mol/L;
(7)弱酸的电离平衡常数越大,其酸性越强,等pH的弱酸溶液,酸性越强的酸其物质的量浓度越小,弱酸根离子水解程度越小,结合强酸能和弱酸盐反应制取弱酸分析解答.
解答 解:(1)CO2含有C=O键,为共价化合物,电子式为 ,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,
,
故答案为: ,
, ;
;
(2)a.加水稀释,促进电离,且氢离子浓度减小,pH增大,故选;
b.加入少量乙酸钠固体,抑制电离,电离程度减小,故不选;
c.通氯化氢,酸性增强,pH减小,故C不选;
d.加入少量苛性钠固体,促进电离,且氢离子浓度减小,pH增大,故选;
故答案为:ad;
(3)根据图可知,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,所以水解方程式为Na2S2O5+H2O=2NaHSO3,
故答案为:Na2S2O5+H2O=2NaHSO3;
(4)根据Ksp[BaSO4]=c(Ba2+)•c(SO42-),可知需要c(Ba2+)=$\frac{Ksp(BaS{O}_{4})}{c(S{{O}_{4}}^{2-})}$=$\frac{1×1{0}^{-10}}{1×1{0}^{-5}}$=10-5mol•L-1,
则溶液中SO32-的最大浓度c(SO32-)=$\frac{Ksp(BaS{O}_{3})}{c(B{a}^{2+})}$=$\frac{5×1{0}^{-7}}{1{0}^{-5}}$=0.05mol•L-1,
故答案为:0.05;
(5)用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体,反应的离子方程式为:NO+NO2+2OH-=2NO2-+H2O,
故答案为:NO+NO2+2OH-=2NO2-+H2O;
(6)①当水电离出的OH-离子浓度最大时,说明此时的溶液是碳酸钠溶液,对水的电离起促进作用,所以离子溶液浓度大小为c(Na+)>c(CO32-)>c(HCO3-),
故答案为:c(Na+)>c(CO32-)>c(HCO3-);
②水电离出的氢离子与氢氧根离子的浓度始终相等,a是没有通二氧化碳的情况,即pH=10的 NaOH溶液,则c(H+)=1×10-10mol/L,而氢离子来源于水的电离,所以水电离出的c(H+)=1×10-10mol/L,b点是强碱溶液对水的电离起抑制作用,所以溶液中的c(H+)<1×10-7mol/L,
故答案为:1×10-10mol/L;小于;
(7)酸的电离平衡常数HCOOH>H2CO3>HCN>HCO3-,则酸根离子水解程度CO32->CN->HCO3->HCOO-,
a.酸性强弱顺序是HCOOH>H2CO3>HCN>HCO3-,强酸能和弱酸盐反应生成弱酸,所以反应方程式为2HCOOH+CO32-=2HCOO-+H2O+CO2↑,故a正确;
b.等pH、等体积的HCOOH和HCN,n(HCN)>n(HCOOH),中和酸需要碱的物质的量与酸的物质的量、酸的元数成正比,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故b错误;
c.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子浓度大,故c错误.
故选bc.
点评 本题考查较综合,涉及酸碱混合计算、元素周期表的应用、图象分析、离子浓度等,为高频考点,把握反应原理及图象分析等为解答的关键,侧重分析与应用能力的考查,题目难度较大

| A. | Ca(OH)2溶液 | B. | 浓的CaCl2溶液 | C. | Ba(NO3)2溶液 | D. | H2S的水溶液 |
| A. | 氢氧化钡溶液与稀硫酸反应 SO42-+Ba2+═BaSO4↓ | |
| B. | 氢氧化钠溶液与稀硫酸反应 OH-+H+═H2O | |
| C. | 铁与氯化铁溶液反应 Fe+Fe3+═2Fe2+ | |
| D. | 碳酸钙溶于稀盐酸中 CO32-+2H+═H2O+CO2↑ |
| A. | B的氢化物和E的氢化物能相互反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 金属D能在A的最高价氧化物中燃烧,生成A的化合物 | |
| D. | E单质的水溶液使紫色石蕊试液先变红后褪色,说明E单质具有漂白性 |
| A. | 1085℃ | B. | 1160℃ | C. | 1200℃ | D. | 1535℃ |
| A. | 锌与镁 | B. | 铁与锌 | C. | 铝与铁 | D. | 镁与铁 |
| A. | 0.1 mol/L | B. | 0.5mol/L | C. | 1 mol/L | D. | 10 mol/L |
| A. | 2个-CH3,能生成4种一氯代物 | B. | 3个-CH3,能生成4种一氯代物 | ||
| C. | 3个-CH3,能生成5种一氯代物 | D. | 4个-CH3,能生成4种一氯代物 |
 回答问题
回答问题