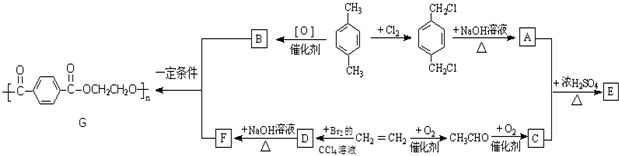
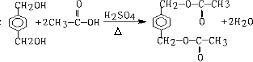
题目内容
9.下列离子方程式书写正确的是( )| A. | 氢氧化钡溶液与稀硫酸反应 SO42-+Ba2+═BaSO4↓ | |
| B. | 氢氧化钠溶液与稀硫酸反应 OH-+H+═H2O | |
| C. | 铁与氯化铁溶液反应 Fe+Fe3+═2Fe2+ | |
| D. | 碳酸钙溶于稀盐酸中 CO32-+2H+═H2O+CO2↑ |
分析 A.漏写生成水的离子反应;
B.反应生成硫酸钠和水;
C.电子、电荷不守恒;
D.碳酸钙在离子反应中保留化学式.
解答 解:A.氢氧化钡溶液与稀硫酸反应的离子反应为2OH-+2H++SO42-+Ba2+═BaSO4↓+2H2O,故A错误;
B.氢氧化钠溶液与稀硫酸反应的离子反应为OH-+H+═H2O,故B正确;
C.铁与氯化铁溶液反应的离子反应为Fe+2Fe3+═3Fe2+,故C错误;
D.碳酸钙溶于稀盐酸中的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故D错误;
故选B.
点评 本题考查离子反应方程式的书写的正误判断,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
19.下列反应的离子方程式正确的是( )
| A. | 铁和稀硝酸反应 Fe+2H+═Fe2++H2↑ | |
| B. | 氯化铁溶液滴入沸水 Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ | |
| C. | 硝酸银溶液中滴入食盐水 NaCl+Ag+═AgCl↓+Na+ | |
| D. | 氯气通入烧碱溶液 Cl2+2OH-═Cl-+ClO-+H2O |
17.根据有机化合物的命名原则,下列命名不正确的是( )
| A. | 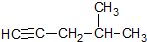 :4-甲基-1-戊炔 :4-甲基-1-戊炔 | B. | CH3CH(CH3)CH=CHCH3:2-甲基-3-戊烯 | ||
| C. | 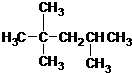 :2,2,4-三甲基戊烷 :2,2,4-三甲基戊烷 | D. |  :间二硝基苯 :间二硝基苯 |
4.下列离子组在指定溶液中能大量共存的是( )
| A. | 强酸溶液中:K+、Fe2+、MnO4-、SO42- | |
| B. | $\frac{{K}_{w}}{c(O{H}^{-})}$=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- | |
| C. | 既能溶解Al(OH)3又能溶解 H2SiO3的溶液中:Na +、CO32-、SO32-、NO3- | |
| D. | 在含有大量HCO3-的溶液中:K+、Na+、AlO2-、Br- |
14.将一定量的Na2O2和NaHCO3混合后,在密闭容器中加热充分反应,排出气体,冷却后有固体物质剩余,下列选项不正确的是( )
| Na2O2/mol | NaHCO3/mol | 剩余固体成分 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2Na2CO3 |
| C | 2 | 1 | Na2CO3、NaOH、Na2O2 |
| D | 2 | 2 | NaOH、Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
18. (1)CO2分子的电子式为
(1)CO2分子的电子式为 ;Na2O2的电子式为
;Na2O2的电子式为
(2)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是ad.(选填序号)
a.加水稀释 b.加入少量乙酸钠固体 c.通氯化氢 d.加入少量苛性钠固体
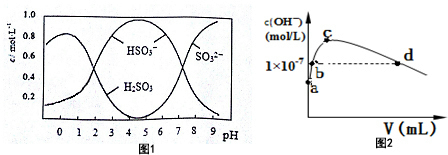
(3)葡萄酒中常用Na2S2O5做抗氧化剂.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图1所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式NO+NO2+2OH-=2NO2-+H2O.
(6)常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离产生的OH-离子浓度(c)的关系如图2所示
①c点溶液中离子浓度由大至小的关系是:c(Na+)>c(CO32-)>c(HCO3-).
②a点溶液中由水电离产生的c(H+)=1×10-10mol/L;b点溶液中c(H+)小于1×10-7mol/L(填写“等于”、“大于”或“小于”).
(7)部分弱酸的电离平衡常数如下表:
下列选项错误的有bc.
a.2HCOOH+CO32-═2HCOO-+H2O+CO2↑
b.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
c.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者.
 (1)CO2分子的电子式为
(1)CO2分子的电子式为 ;Na2O2的电子式为
;Na2O2的电子式为
(2)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是ad.(选填序号)
a.加水稀释 b.加入少量乙酸钠固体 c.通氯化氢 d.加入少量苛性钠固体
(3)葡萄酒中常用Na2S2O5做抗氧化剂.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图1所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式NO+NO2+2OH-=2NO2-+H2O.
(6)常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离产生的OH-离子浓度(c)的关系如图2所示
①c点溶液中离子浓度由大至小的关系是:c(Na+)>c(CO32-)>c(HCO3-).
②a点溶液中由水电离产生的c(H+)=1×10-10mol/L;b点溶液中c(H+)小于1×10-7mol/L(填写“等于”、“大于”或“小于”).
(7)部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25°C)) | Ki=1.77×10-14 | Ki=4.9×10-14 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
a.2HCOOH+CO32-═2HCOO-+H2O+CO2↑
b.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
c.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者.
19.下列有关化学反应原理的叙述中,不正确的是( )
| A. | 常温pH=3的硫酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 | |
| B. | 用明矾净水是因为Al3+水解生成的Al(OH)3胶粒能凝聚水中的悬浮物 | |
| C. | 除去MgCl2溶液中的FeCl3,可向其中加入MgCO3 | |
| D. | 除去锅炉水垢中的CaSO4,可加入Na2CO3溶液将其转化为CaCO3 |
 氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置:
氯气的实验室制法是MnO2和浓盐酸在加热条件下反应,若将MnO2换成KMnO4、KClO3等氧化剂氧化浓盐酸亦可快速制取氯气.根据上述反应原理,有人提出猜想:能否利用Na2O2的强氧化性氧化浓盐酸得到氯气呢?某课外小组在实验室进行了探索性实验,设计了如图所示装置: