题目内容
6.短周期元素 A、B、C、D、E 的原子序数依次增大;A 的最高价氧化物与 B 的氢化物在水中反应得到的生成物既可与酸反应又可与碱反应;C、D 为金属元素,且 D 原子最外层电子数等于其 K 层电子数,而 C 的阳离子半径大于 D 的阳离子;若往 E 单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色.下列说法中正确的是( )| A. | B的氢化物和E的氢化物能相互反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 金属D能在A的最高价氧化物中燃烧,生成A的化合物 | |
| D. | E单质的水溶液使紫色石蕊试液先变红后褪色,说明E单质具有漂白性 |
分析 短周期元素 A、B、C、D、E 的原子序数依次增大;A 的最高价氧化物与 B 的氢化物在水中反应得到的生成物既可与酸反应又可与碱反应,为弱酸铵盐,则A为碳元素、B为N元素;C、D 为金属元素,且 D 原子最外层电子数等于其 K 层电子数,D处于IIA则,而 C 的阳离子半径大于 D 的阳离子,则C为Na、D为Mg;往 E 单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色,则E为Cl元素.
解答 解:短周期元素 A、B、C、D、E 的原子序数依次增大;A 的最高价氧化物与 B 的氢化物在水中反应得到的生成物既可与酸反应又可与碱反应,为弱酸铵盐,则A为碳元素、B为N元素;C、D 为金属元素,且 D 原子最外层电子数等于其 K 层电子数,D处于IIA则,而 C 的阳离子半径大于 D 的阳离子,则C为Na、D为Mg;往 E 单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色,则E为Cl元素.
A.B的氢化物和E的氢化物能相互反应生成NH4Cl,含有离子键、共价键,故A错误;
B.C为Na元素,在元素周期表中的位置是第三周期第ⅠA族,故B正确;
C.金属Mg能在二氧化碳中燃烧生成MgO与碳,故C错误;
D.氯水中HCl具有漂白性,氯气没有漂白性,故D错误,
故选:B.
点评 本题考查结构性质位置关系综合应用,推断元素是解题关键,需要学生熟练元素化合物性质,难度中等.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
16.下列叙述中正确的是( )
| A. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| B. | 反应N2(g)+3H2(g)?2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 | |
| C. | 同温、同浓度的硫酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| D. | 硫酸工业中二氧化硫的催化氧化,不采用高压是因为压强对SO2转化率无影响 |
17.根据有机化合物的命名原则,下列命名不正确的是( )
| A. | 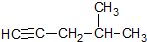 :4-甲基-1-戊炔 :4-甲基-1-戊炔 | B. | CH3CH(CH3)CH=CHCH3:2-甲基-3-戊烯 | ||
| C. | 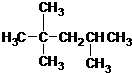 :2,2,4-三甲基戊烷 :2,2,4-三甲基戊烷 | D. |  :间二硝基苯 :间二硝基苯 |
14.将一定量的Na2O2和NaHCO3混合后,在密闭容器中加热充分反应,排出气体,冷却后有固体物质剩余,下列选项不正确的是( )
| Na2O2/mol | NaHCO3/mol | 剩余固体成分 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2Na2CO3 |
| C | 2 | 1 | Na2CO3、NaOH、Na2O2 |
| D | 2 | 2 | NaOH、Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
18. (1)CO2分子的电子式为
(1)CO2分子的电子式为 ;Na2O2的电子式为
;Na2O2的电子式为
(2)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是ad.(选填序号)
a.加水稀释 b.加入少量乙酸钠固体 c.通氯化氢 d.加入少量苛性钠固体
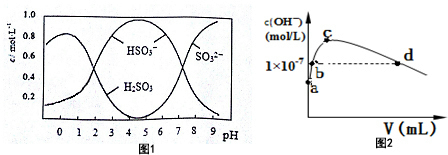
(3)葡萄酒中常用Na2S2O5做抗氧化剂.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图1所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式NO+NO2+2OH-=2NO2-+H2O.
(6)常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离产生的OH-离子浓度(c)的关系如图2所示
①c点溶液中离子浓度由大至小的关系是:c(Na+)>c(CO32-)>c(HCO3-).
②a点溶液中由水电离产生的c(H+)=1×10-10mol/L;b点溶液中c(H+)小于1×10-7mol/L(填写“等于”、“大于”或“小于”).
(7)部分弱酸的电离平衡常数如下表:
下列选项错误的有bc.
a.2HCOOH+CO32-═2HCOO-+H2O+CO2↑
b.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
c.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者.
 (1)CO2分子的电子式为
(1)CO2分子的电子式为 ;Na2O2的电子式为
;Na2O2的电子式为
(2)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是ad.(选填序号)
a.加水稀释 b.加入少量乙酸钠固体 c.通氯化氢 d.加入少量苛性钠固体
(3)葡萄酒中常用Na2S2O5做抗氧化剂.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图1所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式NO+NO2+2OH-=2NO2-+H2O.
(6)常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离产生的OH-离子浓度(c)的关系如图2所示
①c点溶液中离子浓度由大至小的关系是:c(Na+)>c(CO32-)>c(HCO3-).
②a点溶液中由水电离产生的c(H+)=1×10-10mol/L;b点溶液中c(H+)小于1×10-7mol/L(填写“等于”、“大于”或“小于”).
(7)部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25°C)) | Ki=1.77×10-14 | Ki=4.9×10-14 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
a.2HCOOH+CO32-═2HCOO-+H2O+CO2↑
b.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
c.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者.
16. t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
(1)计算t℃时该反应平衡常数的值为K=1
(2)计算该反应在0-3min时间内产物Z的平均反应速率:0.117mol/L•min,
(3)容器内混合气体的平均相对分子质量比起始投料时增大,(填“增大”、“减小”或“不变”)
(4)16min后,改变的条件为加入Y3.24mol,(注明物质的量)
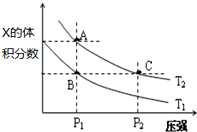
(5)在温度为T1、T2时,平衡体系中Z的体积分数随压强的变化如图所示,
①下列措施一定能增大该反应正反应速率的是ad,一定能使平衡向正反应方向移动的是cd.
a.升高温度 b.保持容器体积不变,充入惰性气体
c.分离出Z物质 d.缩小容器体积增大压强
②A和C点的正反应速率大小关系为vA<vC T2温度时,B点的正反应速率和逆反应速率大小关系为v正=v逆.
 t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.| t/min | X/mol | Y/mol | Z/mol |
| 0 | 2.00 | 4.00 | 0 |
| 1 | 1.80 | 3.60 | 0.40 |
| 3 | 1.65 | 3.30 | 0.70 |
| 5 | 1.55 | 3.10 | 0.90 |
| 14 | 1.00 | 2.00 | 2.00 |
| 16 | 1.00 | 2.00 | 2.00 |
| 20 | 0.50 | 4.24 | 3.00 |
| 22 | 0.50 | 4.24 | 3.00 |
(2)计算该反应在0-3min时间内产物Z的平均反应速率:0.117mol/L•min,
(3)容器内混合气体的平均相对分子质量比起始投料时增大,(填“增大”、“减小”或“不变”)
(4)16min后,改变的条件为加入Y3.24mol,(注明物质的量)
(5)在温度为T1、T2时,平衡体系中Z的体积分数随压强的变化如图所示,
①下列措施一定能增大该反应正反应速率的是ad,一定能使平衡向正反应方向移动的是cd.
a.升高温度 b.保持容器体积不变,充入惰性气体
c.分离出Z物质 d.缩小容器体积增大压强
②A和C点的正反应速率大小关系为vA<vC T2温度时,B点的正反应速率和逆反应速率大小关系为v正=v逆.

 实验室制取气体常用的装置如图所示,请回答下列问题.(选用装置时填字母编号)实验室通常用如图所示的装置来制取氨气.回答下列问题:
实验室制取气体常用的装置如图所示,请回答下列问题.(选用装置时填字母编号)实验室通常用如图所示的装置来制取氨气.回答下列问题: