题目内容
3.由锌、铁、铝、镁四种金属中的两种组成的混合物11.5克,与足量的盐酸反应产生的氢气标准状况下为11.2升,则两种金属组成的混合物是( )| A. | 锌与镁 | B. | 铁与锌 | C. | 铝与铁 | D. | 镁与铁 |
分析 假设金属都为+2价,根据电子转移守恒计算金属物质的量,再根据$\overline{M}$=$\frac{{m}_{总}}{{n}_{总}}$计算金属混合物的平衡相对原子质量,平均相对原子质量应介于各组分之间,若金属不与盐酸反应,可以视作其相对原子质量为无穷大;Al为+2价的幸福在这里为:$\frac{27}{3}$×2=18,据此进行解答.
解答 解:标准状况下,11.2L氢气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的平均相对原子质量为:$\frac{11.5}{0.5}$=23,
A.Zn的相对原子质量为65,Mg的相对原子质量为24,均大于23,故A错误;
B.Fe的相对原子质量为56,Zn的相对原子质量为65,均大于23,故B错误;
C.Fe的相对原子质量为56,当Al的化合价为+2价时,可看成其相对原子质量为$\frac{2}{3}$×27=18,金属混合物的平均相对原子质量为23,介于二者之间,故B正确;
D.Mg的相对原子质量为24,Fe的相对原子质量为56,二者平均相对原子质量介于24~56之间,大于23,故D错误;
故选C.
点评 本题考查混合物反应的计算,题目难度中等,利用平均值法即可快速解答,注意Al的化合价与相对原子质量的转化,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
14.将一定量的Na2O2和NaHCO3混合后,在密闭容器中加热充分反应,排出气体,冷却后有固体物质剩余,下列选项不正确的是( )
| Na2O2/mol | NaHCO3/mol | 剩余固体成分 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2Na2CO3 |
| C | 2 | 1 | Na2CO3、NaOH、Na2O2 |
| D | 2 | 2 | NaOH、Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
18. (1)CO2分子的电子式为
(1)CO2分子的电子式为 ;Na2O2的电子式为
;Na2O2的电子式为
(2)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是ad.(选填序号)
a.加水稀释 b.加入少量乙酸钠固体 c.通氯化氢 d.加入少量苛性钠固体
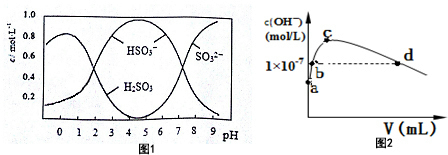
(3)葡萄酒中常用Na2S2O5做抗氧化剂.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图1所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式NO+NO2+2OH-=2NO2-+H2O.
(6)常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离产生的OH-离子浓度(c)的关系如图2所示
①c点溶液中离子浓度由大至小的关系是:c(Na+)>c(CO32-)>c(HCO3-).
②a点溶液中由水电离产生的c(H+)=1×10-10mol/L;b点溶液中c(H+)小于1×10-7mol/L(填写“等于”、“大于”或“小于”).
(7)部分弱酸的电离平衡常数如下表:
下列选项错误的有bc.
a.2HCOOH+CO32-═2HCOO-+H2O+CO2↑
b.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
c.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者.
 (1)CO2分子的电子式为
(1)CO2分子的电子式为 ;Na2O2的电子式为
;Na2O2的电子式为
(2)能使0.1mol/L乙酸溶液的电离程度以及pH都增大的是ad.(选填序号)
a.加水稀释 b.加入少量乙酸钠固体 c.通氯化氢 d.加入少量苛性钠固体
(3)葡萄酒中常用Na2S2O5做抗氧化剂.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图1所示.写出Na2S2O5溶于水时发生的化学方程式Na2S2O5+H2O=2NaHSO3.
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7.把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol•L-1],此时溶液中c(SO32-)≤0.05mol•L-1.
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式NO+NO2+2OH-=2NO2-+H2O.
(6)常温下,向1L pH=10的 NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离产生的OH-离子浓度(c)的关系如图2所示
①c点溶液中离子浓度由大至小的关系是:c(Na+)>c(CO32-)>c(HCO3-).
②a点溶液中由水电离产生的c(H+)=1×10-10mol/L;b点溶液中c(H+)小于1×10-7mol/L(填写“等于”、“大于”或“小于”).
(7)部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25°C)) | Ki=1.77×10-14 | Ki=4.9×10-14 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
a.2HCOOH+CO32-═2HCOO-+H2O+CO2↑
b.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
c.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者.
8.油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装.下列气体中最不应该充入的是( )
| A. | 氮气 | B. | 二氧化碳 | C. | 氧气 | D. | 氦气 |
13.下列说法中正确的是( )
| A. | 如果盐酸的浓度是醋酸的两倍,则盐酸中的H+浓度也是醋酸中的两倍 | |
| B. | 将NaOH溶液和氨水各稀释一份,两者的OH-浓度均减小到原来的$\frac{1}{2}$ | |
| C. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| D. | 若电解质溶液的导电能力也可能比强电解质溶液的强 |
 实验室制取气体常用的装置如图所示,请回答下列问题.(选用装置时填字母编号)实验室通常用如图所示的装置来制取氨气.回答下列问题:
实验室制取气体常用的装置如图所示,请回答下列问题.(选用装置时填字母编号)实验室通常用如图所示的装置来制取氨气.回答下列问题: