题目内容
已知A、B、C、D是短周期元素,其中只有D的原子序数大于10,A与B可形成正四面体结构的分子,甲的化学式通常用D元素符号表示,乙是由2个C原子组成的单质,丙分子中A与B原子的分数比是2:1,丁是由A、B、C三种原子构成的化合物,甲、乙、丙具有相同的电子数.
(1)丙的电子式为 ;
(2)在常温下,若1mol甲与乙完全燃烧放出296KJ热量,写出甲和乙反应的热化学方程式 ;
(3)以铂为电极,KOH为电解质溶液,在两极分别通入乙和丙可以形成原电池,写出正极的电极方程式 ;
(4)写出丁物质表现氧化性的化学方程式 ;
(5)请写出一种物质X的化学式,使它满足:①X能与乙发生反应;②等物质量的X和丙分别与乙反应,消耗相同质量的乙.X的分子式为 .
(1)丙的电子式为
(2)在常温下,若1mol甲与乙完全燃烧放出296KJ热量,写出甲和乙反应的热化学方程式
(3)以铂为电极,KOH为电解质溶液,在两极分别通入乙和丙可以形成原电池,写出正极的电极方程式
(4)写出丁物质表现氧化性的化学方程式
(5)请写出一种物质X的化学式,使它满足:①X能与乙发生反应;②等物质量的X和丙分别与乙反应,消耗相同质量的乙.X的分子式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A与B可形成正四面体结构的分子,A、B的原子序数小于10,则A、B为C、H元素;丙分子中A与B原子的分数比是2:1,则A为H元素、B为C元素;由于甲、乙、丙具有相同的电子数,则丙只能为C2H4;丙中含有16个电子,乙是由2个C原子组成的单质,其含有16个电子,则乙的原子序数为8,为O元素;甲为S单质,D为S元素;丁是由A、B、C三种原子构成的化合物,则丁为据此进行解答.
解答:
解:A与B可形成正四面体结构的分子,A、B的原子序数小于10,甲为甲烷,则A、B为C、H元素;丙分子中A与B原子的分数比是2:1,则A为H元素、B为C元素;由于甲、乙、丙具有相同的电子数,则丙只能为C2H4;丙中含有16个电子,乙是由2个C原子组成的单质,其含有16个电子,则乙的原子序数为8,为O元素;甲为S单质,D为S元素,
(1)根据分析可知,丙为乙烯,乙烯为共价化合物,乙烯分子中碳碳以双键相连,碳剩余价键被H饱和,由此写出电子式为: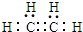 ,
,
故答案为: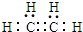 ;
;
(2)甲为甲烷、乙为氧气,在常温下,若1mol甲烷与氧气完全燃烧放出296KJ热量,写出甲烷与氧气反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-296kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-296kJ/mol;
(3)乙为氧气、丙为乙烯,以铂为电极,KOH为电解质溶液,在两极分别通入氧气和乙烯可以形成原电池,正极氧气得到电子生成氢氧根离子,则正极的电极方程式为:O2+4e-+2H2O=4OH-,
故答案为:O2+4e-+2H2O=4OH-;
(4)丁有C、H、O元素组成,丁可以为HCHO,甲醛与氢气反应生成甲醇,该反应中甲醛表现氧化性,反应的化学方程式为:HCHO+H2
CH3OH,
故答案为:HCHO+H2
CH3OH;
(5)物质X满足:①X能与氧气发生反应;②等物质量的X和C2H4分别与氧气反应,消耗相同质量的氧气,则X可以为:C2H6O、C3H4O2,
故答案为:C2H6O、C3H4O2.
(1)根据分析可知,丙为乙烯,乙烯为共价化合物,乙烯分子中碳碳以双键相连,碳剩余价键被H饱和,由此写出电子式为:
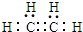 ,
,故答案为:
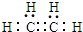 ;
;(2)甲为甲烷、乙为氧气,在常温下,若1mol甲烷与氧气完全燃烧放出296KJ热量,写出甲烷与氧气反应的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-296kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-296kJ/mol;
(3)乙为氧气、丙为乙烯,以铂为电极,KOH为电解质溶液,在两极分别通入氧气和乙烯可以形成原电池,正极氧气得到电子生成氢氧根离子,则正极的电极方程式为:O2+4e-+2H2O=4OH-,
故答案为:O2+4e-+2H2O=4OH-;
(4)丁有C、H、O元素组成,丁可以为HCHO,甲醛与氢气反应生成甲醇,该反应中甲醛表现氧化性,反应的化学方程式为:HCHO+H2
| 催化剂 |
故答案为:HCHO+H2
| 催化剂 |
(5)物质X满足:①X能与氧气发生反应;②等物质量的X和C2H4分别与氧气反应,消耗相同质量的氧气,则X可以为:C2H6O、C3H4O2,
故答案为:C2H6O、C3H4O2.
点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力,注意掌握原子结构与元素周期律、元素周期表的关系.

练习册系列答案
相关题目
将适量铜粉放入硫酸铁溶液中,完全反应后,溶液中的Cu2+和Fe3+的物质的量浓度相等,则已反应的Fe3+和原溶液中Fe3+总物质的量之比是( )
| A、2:3 | B、3:2 |
| C、2:5 | D、1:2 |
下列有关硫的叙述中,不正确的是( )
| A、粘附在试管壁上的硫可用二硫化碳清洗 |
| B、S2和S8是同素异形体 |
| C、硫在自然界中主要以化合态形式存在 |
| D、硫粉和铜粉混合共热生成黑色的CuS |
下列有关电解质溶液中粒子浓度关系正确的是( )
| A、SO2的水溶液中:c(H+)>c(HSO3-)=2c(SO32-) |
| B、室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| C、室温下,pH=1的NaHSO4溶液:c(SO42-)+c(OH-)=0.1mol |
| D、含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4+)+c(C2O42-)+c(H2C2O4)] |
以Mg、MgO、Mg(OH)2、MgCO3、MgSO4、BaCl2溶液和盐酸为原料,直接制取M可有多种方法,其中运用复分解反应的( )
| A、二种 | B、三种 | C、四种 | D、五种 |
20℃,已知2g氢气点燃后生成水放热235kJ,下列热化学方程式正确的是( )
A、H2(g)+
| ||
| B、H2(g)+O2(g)=2H2O(1)△H=-235kJ.mol-1 | ||
C、H2(g)+
| ||
| D、H2(g)+O2(g)=H2O(1)△H=-470kJ.mol-1 |
常温下能盛放在铁制容器中的物质是( )
| A、浓盐酸 | B、浓硝酸 |
| C、硫酸铜溶液 | D、稀硫酸 |
铁丝在氯气中燃烧的主要产物是FeCl3而不是FeCl2,这并非因为( )
| A、氯气的氧化性很强 |
| B、氯原子的得电子能力很强 |
| C、氯气毒性很强 |
| D、氯气是很活泼的非金属 |
 工业上“固定”和利用CO2能有效地减轻“温室’效应.有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
工业上“固定”和利用CO2能有效地减轻“温室’效应.有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1