题目内容
10.金刚石和石墨在氧气中燃烧的热化学方程式为C(金刚石,s)+O2(g)=CO2(g)△H=-395.41 kJ•mol-1;
C(石墨,s)+O2(g)=CO2(g)△H=-393.51 kJ•mol-1
则下列热化学方程式正确的是( )
| A. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1; | |
| B. | C(石墨,s)=C(金刚石,s)△H=-1.9 kJ•mol-1; | |
| C. | C(石墨,s)=C(金刚石,s)△H=-788.92 kJ•mol-1; | |
| D. | C(石墨,s)=C(金刚石,s)△H=+788.92 kJ•mol-1; |
分析 已知①C(金刚石,s)+O2(g)=CO2(g)△H=-395.41 kJ•mol-1;②C(石墨,s)+O2(g)=CO2(g)△H=-393.51 kJ•mol-1,根据盖斯定律②-①可得:C(石墨,s)=C(金刚石,s),据此计算出石墨转化成金刚石的焓变即可.
解答 解:①C(金刚石,s)+O2(g)=CO2(g)△H=-395.41 kJ•mol-1;
②C(石墨,s)+O2(g)=CO2(g)△H=-393.51 kJ•mol-1,
根据盖斯定律②-①可得:C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,
故选A.
点评 本题考查了盖斯定律的应用,题目难度不大,明确盖斯定律的内容及应用方法为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
20.如表列出了A-G 7种元素在周期表中的位置
(1)这7种元素中化学性质最不活泼的是Al(填元素符号)
(2)D元素的最高价氧化物对应水化物与氢氧化钠反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg(填元素符号)
(4)E元素氢化物的结构式是H-O-H,该氢化物在常温下跟B发生反应的化学方程式是2K+2H2O=2KOH+H2↑.
(5)F元素跟A元素形成化合物的电子式是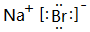 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.
(6)C.D的单质作电极,稀硫酸作电解质溶液,构成原电池.其负极的电极反应式为:Mg-2e-=Mg2+.
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
(2)D元素的最高价氧化物对应水化物与氢氧化钠反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O
(3)A、B、C三种元素按原子半径由大到小的顺序排列为K>Na>Mg(填元素符号)
(4)E元素氢化物的结构式是H-O-H,该氢化物在常温下跟B发生反应的化学方程式是2K+2H2O=2KOH+H2↑.
(5)F元素跟A元素形成化合物的电子式是
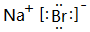 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.(6)C.D的单质作电极,稀硫酸作电解质溶液,构成原电池.其负极的电极反应式为:Mg-2e-=Mg2+.
1.将pH=1的稀硫酸慢慢加入一定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100mL(混合时溶液体积的变化忽略不计),且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度约为( )
| A. | 0.22 mol/L | B. | 0.11 mol/L | C. | 0.022 mol/L | D. | 0.011 mol/L |
18.同主族两种元素原子的核外电子数的差值可能是( )
| A. | 6 | B. | 14 | C. | 26 | D. | 30 |
5. 某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
 某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为BH4-+8OH--8e-=BO2- | |
| C. | b极上的电极反应式为H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mol e- |
2.把氢氧化钠溶液和硫酸铜溶液加入某病人的尿液中,微热时如果观察到红色沉淀,说明该病人的尿液中含有( )
| A. | 食醋 | B. | 酒精 | C. | 食盐 | D. | 葡萄糖 |
20. 温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗干净滴定管 B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作一次 E.检查滴定管是否漏水
F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上
2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)EABCFGD
(2)操作F中应该选择图中乙_滴定管(填标号).
(3)滴定时边滴边摇动锥 形瓶,眼睛应观察B
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化滴定终点溶液颜色的变化是无色变浅红色且半分钟内不褪色
(4)滴定结果如表所示:
滴定中误差较大的是第2次实验,造成这种误差的可能原因是ABD.
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)该盐酸的浓度为0.1000mol/L.
(6)如果准确移取20.00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?是(填“是”或“否”).
 温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:A.用蒸馏水洗干净滴定管 B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作一次 E.检查滴定管是否漏水
F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上
2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)EABCFGD
(2)操作F中应该选择图中乙_滴定管(填标号).
(3)滴定时边滴边摇动锥 形瓶,眼睛应观察B
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化滴定终点溶液颜色的变化是无色变浅红色且半分钟内不褪色
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 1 | 20 | 1.02 | 21.03 | |
| 2 | 20 | 2.00 | 25.00 | |
| 3 | 20 | 0.60 | 20.60 | |
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)该盐酸的浓度为0.1000mol/L.
(6)如果准确移取20.00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?是(填“是”或“否”).