题目内容
18.同主族两种元素原子的核外电子数的差值可能是( )| A. | 6 | B. | 14 | C. | 26 | D. | 30 |
分析 根据相邻周期同一主族元素原子序数之差,若元素为ⅠA、ⅡA族元素,则等于上一周期元素的种类,若为其他主族元素等于下一周期元素的种类,以此解答该题.
解答 解:因周期表中1~6周期所含元素种数为2、8、8、18、18、32,第7周期未排满,
而相邻周期同一主族元素原子序数之差,若元素为ⅠA、ⅡA族元素,则等于上一周期元素的种类,
若为其他主族元素等于下一周期元素的种类,
因此,同一主族相邻元素核外电子数(或原子序数)可能相差2、8、18或32,
而题目中未说两种元素一定相邻,那么它们相差的电子数,可能为8+18=26.
故选C.
点评 本题考查了同主族两种元素原子的核外电子数的差值,侧重于学生的分析能力的考查,难度较大,能正确分析元素周期表中同主族元素间的关系是解本题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究.
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:

请回答下列问题:
(1)仪器A的名称是球形干燥管.
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃酒精灯⑥停止通N2⑦停止加热.正确的操作顺序是②①④③⑤⑦⑥
实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏(或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行
(4)TiCl4是制取航天航空工业材料--钛合金的重要原料.某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素.
取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2.
(5)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(6)检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中加入硝酸酸化的AgNO3若没有产生沉淀,则已洗干净.
(7)一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 NH4Fe(SO4)2标准溶液20mL
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是:抑制NH4Fe(SO4)2水解.
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管.
(2)实验开始前后的操作包括:①检查装置气密性,②组装仪器,③通N2一段时间,④加装药品,⑤点燃酒精灯⑥停止通N2⑦停止加热.正确的操作顺序是②①④③⑤⑦⑥
实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏(或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行
(4)TiCl4是制取航天航空工业材料--钛合金的重要原料.某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素.
取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗,再烘干、焙烧除去水分得到粉体TiO2.
(5)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(6)检验沉淀是否洗涤干净的方法是取最后一次洗涤液于试管中加入硝酸酸化的AgNO3若没有产生沉淀,则已洗干净.
(7)一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 NH4Fe(SO4)2标准溶液20mL
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是:抑制NH4Fe(SO4)2水解.
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
9.生活垃圾无害化处理的方法之一是垃圾发电技术的应用,下列说法正确的是( )
| A. | 生活垃圾焚烧处理后体积一般可减少40%~50% | |
| B. | 生活垃圾焚烧处理后体积一般可减少80%~90% | |
| C. | 因为是封闭式焚烧处理所以没有烟气排放 | |
| D. | 发出的电也有污染,不能用作生活用电 |
13.下列有机物的命名正确的是( )
| A. |  :2-羟基丁烷 :2-羟基丁烷 | B. |  :3-乙基-1-丁烯 :3-乙基-1-丁烯 | ||
| C. |  :1,3-二溴丙烷 :1,3-二溴丙烷 | D. |  :2,2,3-三甲基戊烷 :2,2,3-三甲基戊烷 |
3.设NA为阿伏加德罗常数值.下列有关叙述正确的是( )
| A. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| B. | 50mL18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 78g Na2O2晶体中含有的离子数目为3NA |
10.金刚石和石墨在氧气中燃烧的热化学方程式为
C(金刚石,s)+O2(g)=CO2(g)△H=-395.41 kJ•mol-1;
C(石墨,s)+O2(g)=CO2(g)△H=-393.51 kJ•mol-1
则下列热化学方程式正确的是( )
C(金刚石,s)+O2(g)=CO2(g)△H=-395.41 kJ•mol-1;
C(石墨,s)+O2(g)=CO2(g)△H=-393.51 kJ•mol-1
则下列热化学方程式正确的是( )
| A. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1; | |
| B. | C(石墨,s)=C(金刚石,s)△H=-1.9 kJ•mol-1; | |
| C. | C(石墨,s)=C(金刚石,s)△H=-788.92 kJ•mol-1; | |
| D. | C(石墨,s)=C(金刚石,s)△H=+788.92 kJ•mol-1; |
7.下列各组离子在给定条件下能大量共存的是( )
| A. | 在pH=1的溶液中:NH+4、K+、CH3COO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- |
8.下列措施不能加快燃煤燃烧速率的是( )
| A. | 加入生石灰 | B. | 粉碎成煤粉 | ||
| C. | 多鼓入空气 | D. | 燃烧时掺入少量水 |
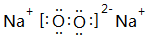 .
.