题目内容
5. 某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为BH4-+8OH--8e-=BO2- | |
| C. | b极上的电极反应式为H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mol e- |
分析 由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2得电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,原电池工作时,阳离子向正极移动,阴离子向负极移动,以此解答该题.
解答 解:由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2得电子被还原生成OH-,
A.该装置是原电池,原电池放电时,阳离子向正极移动,所以Na+从a极区移向b极区,故A错误;
B.反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故B正确;
C.b电极反应式应该为H2O2+2e-=2OH-,故C错误;
D.根据b电极反应式H2O2+2e-=2OH-可判断每消耗3molH2O2,转移的电子为6mol,D错误.
故选B.
点评 本题考查原电池的工作原理,为高频考点,侧重于学生的分析能力的考查,题目难度中等,本题注意根据物质化合价的变化判断两极反应为解答该题的关键,注意电极反应式的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列有机物的命名正确的是( )
| A. |  :2-羟基丁烷 :2-羟基丁烷 | B. |  :3-乙基-1-丁烯 :3-乙基-1-丁烯 | ||
| C. |  :1,3-二溴丙烷 :1,3-二溴丙烷 | D. |  :2,2,3-三甲基戊烷 :2,2,3-三甲基戊烷 |
20.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为W,物质的量浓度为c mol/L,则下列关系中不正确的是( )
| A. | p=$\frac{17V+22400}{22.422.4V}$ | B. | W=$\frac{17c}{ρ}$ | ||
| C. | $\frac{17V}{17V+22400}$=W | D. | C=$\frac{1000Vρ}{17V+22400}$ |
10.金刚石和石墨在氧气中燃烧的热化学方程式为
C(金刚石,s)+O2(g)=CO2(g)△H=-395.41 kJ•mol-1;
C(石墨,s)+O2(g)=CO2(g)△H=-393.51 kJ•mol-1
则下列热化学方程式正确的是( )
C(金刚石,s)+O2(g)=CO2(g)△H=-395.41 kJ•mol-1;
C(石墨,s)+O2(g)=CO2(g)△H=-393.51 kJ•mol-1
则下列热化学方程式正确的是( )
| A. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1; | |
| B. | C(石墨,s)=C(金刚石,s)△H=-1.9 kJ•mol-1; | |
| C. | C(石墨,s)=C(金刚石,s)△H=-788.92 kJ•mol-1; | |
| D. | C(石墨,s)=C(金刚石,s)△H=+788.92 kJ•mol-1; |
14.SO2溶于水后所得的溶液的性质是 ( )
| A. | 有氧化性、无还原性、无酸性 | B. | 无氧化性、有还原性、无酸性 | ||
| C. | 有氧化性、有还原性、有酸性 | D. | 有氧化性、无还原性、有酸性 |
15.化学是以实验为基础的科学,关于下列各实验装置的叙述中,正确的是:( )


| A. | 仪器①可用于乙醇与水分离提纯 | |
| B. | 仪器②可用于称取5.85 g氯化钠固体 | |
| C. | 装置③的烧瓶中应加沸石,以防暴沸 | |
| D. | 装置④从箭头方向进气,用排空气法可收集H2 |
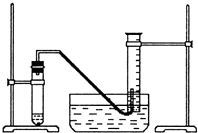 某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如下:
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如下: