题目内容
17.0.80gCuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.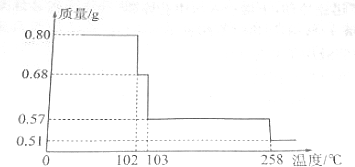
请回答下列问题:
(1)该实验样品脱水的受热仪器应选用坩埚;
(2)试确定200℃时固体物质的化学式CuSO4•H2O(要求写出推断过程).
分析 (1)加热固体时用坩埚;
(2)由图分析可知,CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为0.80g-0.57g=0.23g,根据相应的化学方程式即可确定此时固体物质的化学式.
解答 解:(1)坩埚耐高温,在加热固体时用坩埚盛放;
故答案为:坩埚;
(2)CuSO4•5H2O受热到102℃时开始脱水分解,113℃时可得到较稳定的一种中间物,到258℃时才会继续分解.在200℃时失去的水的质量为0.80g-0.57g=0.23g,
根据反应的化学方程式:
CuSO4•5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4•(5-n)H2O+nH2O
250 18n
0.80g 0.80g-0.57g=0.23g
$\frac{250}{18n}$=$\frac{0.8g}{0.23g}$,解得n=4,
200℃时该固体物质的化学式为CuSO4•H2O;
故答案为:CuSO4•H2O.
点评 本题考查了硫酸铜结晶水含量的测定的有关计算,题目难度中等,分析图象信息是完成本题目的关键,侧重于考查学生对基础知识的应用能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列事实中,一定能说明X、Y两种元素为同一主族的是( )
| A. | 原子半径X<Y | B. | 均有+3价 | ||
| C. | 最外层电子数均为5 | D. | 最外层均有2个电子 |
2.与水发生的复分解反应称为水解反应.例如:Al2S3+6H2O═2Al(OH)3↓+3H2S↑.根据上述观点,下列说法中不正确的是( )
| A. | NaF 的水解产物是NaOH 和HF | B. | CaO2 的水解产物是Ca(OH)2 和H2O2 | ||
| C. | PCl3 的水解产物之一是PH3 | D. | Mg3N2水解产物是Mg(OH)2和NH3 |
6.在恒温恒容的密闭容器中,有可逆反应2NO(g)+O2(g)?2NO2(g).下列能说明该反应已达到化学平衡状态的是( )
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | 反应容器中密度不随时间变化而变化 | |
| C. | 混合气体颜色深浅保持不变 | |
| D. | NO2、NO、O2的物质的量浓度之比为2:2:1 |
 ;
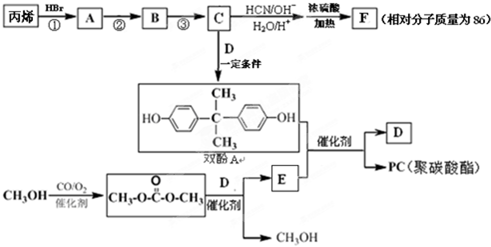
;
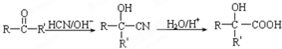
 (R、R′、R″代表羟基)
(R、R′、R″代表羟基) .
. .
. .
.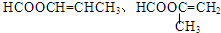 .
.