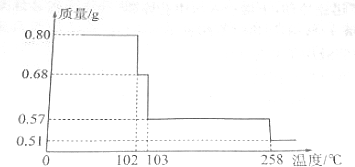
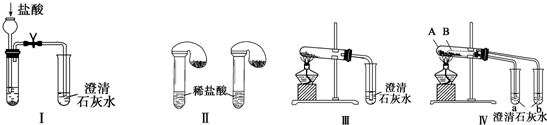
��Ŀ����
12��ҩ�│�������ĺϳ�ԭ��F�����̲��Ͼ�̼���������PC���ĺϳ�·����ͼ��ʾ��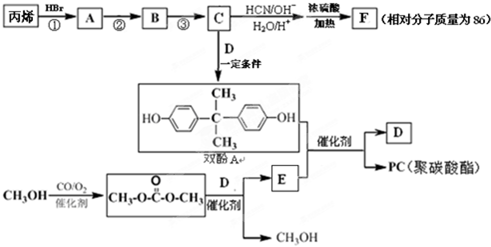
��֪
��
�����뺬�ǻ��Ļ�����ɷ���������������Ӧ��
 ��R��R�䡢R������ǻ���
��R��R�䡢R������ǻ�����ش�
��1��C�ɱ�ϩ����Ӧ�١��ۺϳɣ�C�ĺ˴Ź�������ֻ��һ�ַ壮
a���ķ�Ӧ�����Ǽӳɷ�Ӧ��
b���ڵķ�Ӧ�Լ�����������������ˮ��Һ�����ȣ�
c���۵Ļ�ѧ����ʽ��
 ��
����2��9.4g ��D�뱥����ˮ��ȫ��Ӧ����33.1g ��ɫ������D�Ľṹ��ʽ��
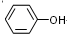 ��
����3��C��D��Ӧ����˫��A�Ļ�ѧ����ʽ��
 ��
����4��F�ж���ͬ���칹�壬������������������ͬ���칹���
�ṹ��ʽ��
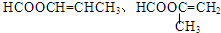 ��
����%2 ���м� �ں���̼̼˫�� ���ܷ���������Ӧ ����������
���� ��ϩ����ϵ�з�Ӧ�õ�C��C��D��Ӧ�õ�˫��A��C�ܺ������ᷢ����Ϣ�еļӳɷ�Ӧ�����������Ϣ��˫��A�Ľṹ��֪��C��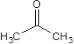 ����B��
����B�� ��D��
��D�� ��A��
��A�� ����ͪ��HCN��Ӧ���ữ�õ���CH3��2C��OH��COOH��M����Է���������86���ȣ�CH3��2C��OH��COOHС18��Ӧ�ǣ�CH3��2C��OH��COOH��Ũ���ᡢ���������·�����������ȥ1����ˮ����F����F����ΪCH2=C��CH3��COOH��
����ͪ��HCN��Ӧ���ữ�õ���CH3��2C��OH��COOH��M����Է���������86���ȣ�CH3��2C��OH��COOHС18��Ӧ�ǣ�CH3��2C��OH��COOH��Ũ���ᡢ���������·�����������ȥ1����ˮ����F����F����ΪCH2=C��CH3��COOH�� ��̼���������D��
��̼���������D�� ����Ӧ�õ�E��״�����EΪ
����Ӧ�õ�E��״�����EΪ ��˫��A��E��Ӧ�õ�������PC����PCΪ
��˫��A��E��Ӧ�õ�������PC����PCΪ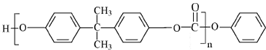 ��
�� ���ݴ˽��
���ݴ˽��
��� �⣺��ϩ����ϵ�з�Ӧ�õ�C��C��D��Ӧ�õ�˫��A��C�ܺ������ᷢ����Ϣ�еļӳɷ�Ӧ�����������Ϣ��˫��A�Ľṹ��֪��C�� ����B��
����B�� ��D��
��D�� ��A��
��A�� ����ͪ��HCN��Ӧ���ữ�õ���CH3��2C��OH��COOH��M����Է���������86���ȣ�CH3��2C��OH��COOHС18��Ӧ�ǣ�CH3��2C��OH��COOH��Ũ���ᡢ���������·�����������ȥ1����ˮ����F����F����ΪCH2=C��CH3��COOH��
����ͪ��HCN��Ӧ���ữ�õ���CH3��2C��OH��COOH��M����Է���������86���ȣ�CH3��2C��OH��COOHС18��Ӧ�ǣ�CH3��2C��OH��COOH��Ũ���ᡢ���������·�����������ȥ1����ˮ����F����F����ΪCH2=C��CH3��COOH�� ��̼���������D��
��̼���������D�� ����Ӧ�õ�E��״�����EΪ
����Ӧ�õ�E��״�����EΪ ��˫��A��E��Ӧ�õ�������PC����PCΪ
��˫��A��E��Ӧ�õ�������PC����PCΪ ��
�� ��
��
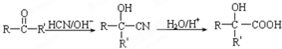
��1��C�DZ�ͪ����ϩ���廯�ⷢ���ӳɷ�Ӧ����2-����飬2-�������������Ƶ�ˮ��Һ����ȡ����Ӧ����2-������2-�������������ɱ�ͪ��
����a���ٵķ�Ӧ�����Ǽӳɷ�Ӧ��
b���ڵķ�Ӧ�Լ�����������������ˮ��Һ�ͼ��ȣ�
c���۵Ļ�ѧ����ʽ�� ��
��
�ʴ�Ϊ���ӳɷ�Ӧ����������ˮ��Һ�����ȣ� ��
��
��2��ͨ�����Ϸ���֪��D�DZ��ӣ���D�Ľṹ��ʽ��  ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��3��C��D��Ӧ����˫��A�Ļ�ѧ����ʽ�� ��
��
�ʴ�Ϊ�� ��
��
��4��F��2-����ϩ�ᣬF�ж���ͬ���칹�壬F��ͬ���칹��������������ٺ��м����ں���̼̼˫�������ܷ���������Ӧ˵������ȩ������������˵�����������������������F��ͬ���칹��ṹ��ʽΪ��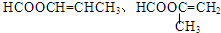 ���ʴ�Ϊ��
���ʴ�Ϊ��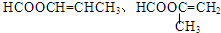 ��
��
���� ���⿼�����л���ĺϳɣ���ȷ�л���Ĺ����ż��������ǽⱾ��ؼ�����CΪͻ�ƿڲ����������ϵķ������з��������ȷ�л���Ӧ�л�ѧ���ı仯���Ѷ��еȣ�

| A�� | K+��Ba2+��OH-��SO42- | B�� | Ag+��NO3-��Cl-��K+ | ||
| C�� | H3O+��NO3-��Fe2+��Na+ | D�� | Cu2+��NH4+��Br-��OH- |
| A�� | ��֪C��ʯī��s��=C�����ʯ��s����H��0������ʯ��ʯī�ȶ� | |
| B�� | C��s��+$\frac{1}{2}$O2��g��=CO��g����H=-101.5 kJ•mol-1���÷���ʽ�ġ�H�ɱ�ʾ̼��ȼ���� | |
| C�� | ��֪��C��s��+O2��g��=CO2��g����H1C��s��+$\frac{1}{2}$O2��g��=CO ��g����H2�����H1����H2 | |
| D�� | Ba��OH��2��aq��+H2SO4��aq����=BaSO4��s��+2H2O��l����H=-2a kJ•mol-1�����κ�ǿ���ǿ����кͷ�Ӧ����1 mol H2O��l���ķ�Ӧ�Ⱦ�Ϊ-a kJ•mol-1 |
| A�� | H2O��g��=H2��g��+$\frac{1}{2}$O2��g����H=242 kJ?mol-1 | B�� | 2H2��g��+O2��g��=2H2O��g����H=-484 kJ?mol-1 | ||
| C�� | H2��g��+$\frac{1}{2}$O2��g��=H2O��1����H=-242 kJ?mol-1 | D�� | 2H2��g��+O2��g��=2H2O��g����H=+484 kJ?mol-1 |
| A�� | AsH3��NH3��PH3 | B�� | PH3��AsH3��NH3 | C�� | NH3��PH3��AsH3 | D�� | NH3��AsH3��PH3 |

 ��
�� ��
��