题目内容
7.在标准状况时,含有2.408×1024个CO2分子的气体,所占有的体积是多少升?其质量为多少克?分析 先根据n=$\frac{N}{{N}_{A}}$计算出二氧化碳的物质的量,然后根据V=nVm计算出标准状况下二氧化碳的体积,再根据m=nM计算出二氧化碳的质量.
解答 解:2.408×1024个CO2分子的物质的量为:n(CO2)=$\frac{2.408×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=4mol,
标准状况下4mol CO2的物质的量为:V(CO2)=22.4L/mol×4mol=89.6L;
4mol CO2的质量为:m(CO2)=44g/mol×4mol=176g,
答:标准状况该二氧化碳的体积为89.6L,质量为176g.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积的关系为解答关键,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
18.2016年l月《自然》杂志报道了中科大的研究人员利用直接电解将二氧化碳高效、清洁地转化成液体甲酸燃料的最新成果.下列有关说法正确的是( )
| A. | CO2和HCOOH均属于弱电解质 | B. | CO2和HCOOH均属于有机化合物 | ||
| C. | CO2转变为HCOOH发生还原反应 | D. | 1mol CO2的体积一定等于22.4L |
12.下列关于常见物质的工业冶炼说法正确的是( )
| A. | 工业制金属钠:电解饱和食盐水 | |
| B. | 工业炼铁:需要用到的原料有铁矿石、焦炭、空气和生石灰 | |
| C. | 冶炼镁:将六水合氯化镁晶体在一定条件下加热得到无水氯化镁,电解熔融氯化镁,可以得到金属镁 | |
| D. | 硫酸工业:在氧气充足的情况下,从接触室进入吸收塔的气体中不可能含有SO2 |
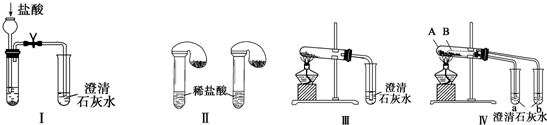
19.按如图实验,反应后可能出现的现象是( )
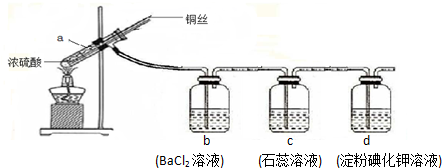

| A. | a装置中有白色固体 | B. | b装置中产生白色沉淀 | ||
| C. | c装置中溶液先变红后褪色 | D. | d装置中溶液变蓝色 |
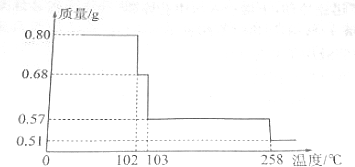
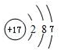 ,最高价氧化物的化学式为:Cl2O7.
,最高价氧化物的化学式为:Cl2O7.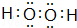 .
.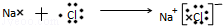 .
.
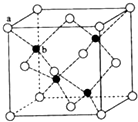 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.