题目内容
3.在一定温度下的定容密闭容器中,表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡的是( )| A. | 混合气体的压强不变 | B. | 混合气体的密度不变 | ||
| C. | 混合气体的物质的量不变 | D. | A、B、C、D物质的量比为1:2:1:1 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、两边的计量数相等,所以混合气体的压强一直不变,故A错误;
B、A为固体,混合气体的密度不变,说明气体的质量不变,所以达平衡状态,故B正确;
C、两边的气体的物质的量相等,所以混合气体的物质的量一直不变,故C错误;
D、A、B、C、D物质的量比为1:2:1:1,不是不变的状态,所以不能说明达平衡状态,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
14. 如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
①2H++2e-═H2 ②O2+2H2O+4e-═4OH-③4OH-═O2+2H2O+4e-.
 如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )①2H++2e-═H2 ②O2+2H2O+4e-═4OH-③4OH-═O2+2H2O+4e-.
| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
11.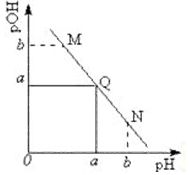 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )| A. | 溶液导电能力M点大于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | 图中b>7 |
18.在一个定容的密闭容器中进行如下反应:2SO2(g)+O2(g)?2SO3(g).已知反应过程中的某一时间SO2、O2和SO3的浓度分别为0.1mol•L-1、0.05mol•L-1和0.3mol•L-1.当反应达平衡时不可能存在的数据正确的是( )
| A. | c(SO2)=0.25 mol•L-1 | B. | c(O2)=0.12 mol•L-1 | ||
| C. | c(SO2)+c(SO3)=0.15 mol•L-1 | D. | c(SO3)+c(O2)=0.3 mol•L-1 |
12.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
13.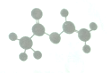 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同 | |
| C. | 该化合物既能发生取代反应,又能发生加成反应和氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
 某同学欲用下列装置探究碳与浓硫酸的反应,并对气体产物进行检验;
某同学欲用下列装置探究碳与浓硫酸的反应,并对气体产物进行检验;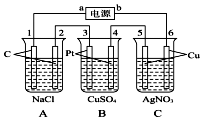 如图,通电5min后,电极5的质量增加2.16g,回答:
如图,通电5min后,电极5的质量增加2.16g,回答: