题目内容
8. 过氧化氢(H2O2)被称为绿色氧化剂,其分子结构如图所示.两个氢原子位于不重合的两个平面上,而两个氧原子位于两平面的交线上.下列有关说法正确的是( )
过氧化氢(H2O2)被称为绿色氧化剂,其分子结构如图所示.两个氢原子位于不重合的两个平面上,而两个氧原子位于两平面的交线上.下列有关说法正确的是( )| A. | 过氧化氢分子中含有H-H键、O-O键 | |
| B. | 过氧化氢分子中存在离子键和共价键 | |
| C. | 过氧化氢分子中只有共价键,其电子式为 | |
| D. | H2O2与H2O互为同位素 |
分析 A、过氧化氢分子中含有H-O键、O-O键;
B、过氧化氢是共价化合物,不存在离子键;
C、过氧化氢中存在氧氧非极性键和氧氢极性键;
D、同位素是核素之间.
解答 解:A、过氧化氢分子中含有H-O键、O-O键,而不存在H-O键,故A错误;
B、过氧化氢是共价化合物,不存在离子键,故B错误;
C、过氧化氢中存在氧氧非极性键和氧氢极性键,其电子式为 ,故C正确;
,故C正确;
D、同位素是核素之间,而H2O2与H2O是两种相同元素形成的化合物,故D错误;
故选C.
点评 本题考查了共价键、离子键,学生要清楚化学键的类型,题目难度不大,侧重于基础知识的考查.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
19.下列有“国防金属”美誉之称的是( )
| A. | 铁 | B. | 金 | C. | 铝 | D. | 镁 |
16.依据下列甲、乙、丙三图,判断下列叙述不正确的是( )


| A. | 甲是原电池,乙是电镀装置 | |
| B. | 甲、乙装置中,锌极上均发生氧化反应 | |
| C. | 乙、丙装置中,阳极均发生氧化反应而溶解 | |
| D. | 丙装置中,铜电极的质量有增有减 |
13.在一定条件下MO3-与M-发生反应;MO3-+5M-+6H+═3M2+3H2O,则下列关于M元素的叙述中正确的是( )
| A. | M的氢化物的水溶液呈酸性 | B. | M2在常温常压下一定是气体 | ||
| C. | MO3-中的M元素只能被还原 | D. | M位于元素周期表的第VA族 |
20.下列化学用语中,书写错误的是( )
| A. | 硫离子的结构示意图: | B. | 氟化钠的电子式: | ||
| C. | CaCl2的电子式: | D. | 次氯酸的结构式:H-Cl-O |
17.工业上用铝土矿(主要成分是Al2O3、SiO2、Fe2O3杂质)提取纯Al2O3再冶炼铝的过程如图所示,下列有关说法不正确的是( )


| A. | 实验室中灼烧操作通常在坩埚中进行 | |
| B. | 若X为烧碱,则Z为氨气,沉淀a为红棕色,可作颜料 | |
| C. | 若X为盐酸,则Z为CO2,溶液丙只含NaCl和Na2CO3 | |
| D. | 上述过程中所发生的反应有分解反应、复分解反应、氧化还原反应 |
17.低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳循环正成为科学家研究的主要课题.最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.该构想技术流程如图1:
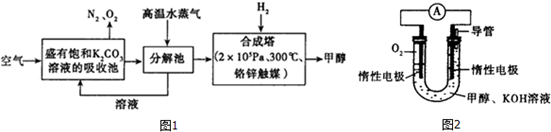
(1)向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解.
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol.
(3)依据甲醇燃烧的反应原理.设计如图2所示的电池装置.该装置负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
(4)已知Ksp(CaCO3)=2.8×10-9mol2•L-2.现将CaCl2溶液与0.02mol•L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为5.6×10-7mol/L.
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),不同温度下得到三组数据:
①实验1前6min的反应速率v(CO2)=0.13 mol/(L.min)(保留小数点后两位,下同).
②实验2条件下平衡常数K=0.17.
③该反应的△H<0 (填“<”或“>”=).

(1)向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解.
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol.
(3)依据甲醇燃烧的反应原理.设计如图2所示的电池装置.该装置负极的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
(4)已知Ksp(CaCO3)=2.8×10-9mol2•L-2.现将CaCl2溶液与0.02mol•L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为5.6×10-7mol/L.
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2.将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),不同温度下得到三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验2条件下平衡常数K=0.17.
③该反应的△H<0 (填“<”或“>”=).