题目内容
17.工业上用铝土矿(主要成分是Al2O3、SiO2、Fe2O3杂质)提取纯Al2O3再冶炼铝的过程如图所示,下列有关说法不正确的是( )
| A. | 实验室中灼烧操作通常在坩埚中进行 | |
| B. | 若X为烧碱,则Z为氨气,沉淀a为红棕色,可作颜料 | |
| C. | 若X为盐酸,则Z为CO2,溶液丙只含NaCl和Na2CO3 | |
| D. | 上述过程中所发生的反应有分解反应、复分解反应、氧化还原反应 |
分析 Al2O3、SiO2可与强碱反应,Al2O3、Fe2O3可与酸反应,如X为烧碱,则a为Fe2O3,溶液甲为NaAlO2和Na2SiO3,Y盐酸或稀硫酸,沉淀b为H2SiO3,溶液乙含有AlCl3,Z为氨水,沉淀c为Al(OH)3,丙为氯化铵、硫酸铵等;
若X为盐酸,a为SiO2,甲含有AlCl3、FeCl3,Y为NaOH,b为Fe(OH)3,溶液乙为NaAlO2,Z为CO2,c为Al(OH)3,丙为NaCl和NaHCO3,以此解答该题.
解答 解:Al2O3、SiO2可与强碱反应,Al2O3、Fe2O3可与酸反应,如X为烧碱,则a为Fe2O3,溶液甲为NaAlO2和Na2SiO3,Y盐酸或稀硫酸,沉淀b为H2SiO3,溶液乙含有AlCl3,Z为氨水,沉淀c为Al(OH)3,丙为氯化铵、硫酸铵等;
若X为盐酸,a为SiO2,甲含有AlCl3、FeCl3,Y为NaOH,b为Fe(OH)3,溶液乙为NaAlO2,Z为CO2,c为Al(OH)3,丙为NaCl和NaHCO3,
A.灼烧固体应在坩埚中进行,故A正确;
B.由以上分析可知,若X为烧碱,则Z为氨气,沉淀a为Fe2O3,为红棕色,可作颜料,故B正确;
C.由以上分析可知,若X为盐酸,则Z为CO2,溶液丙只含NaCl和NaHCO3,故C错误;
D.氢氧化铝生成氧化铝为分解反应,电解氧化铝生成铝的反应为氧化还原反应,其它为复分解反应,故D正确.
故选C.
点评 本题考查化学工艺流程、无机物推断等,题目难度中等,理解工艺流程是解题的关键,需要学生基本扎实的据此与运用知识分析解决问题的能力.注意把握制备原理,把握物质的性质以及相关反应方程式的书写.该题侧重考查铝、硅、钠及其化合物的性质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8. 过氧化氢(H2O2)被称为绿色氧化剂,其分子结构如图所示.两个氢原子位于不重合的两个平面上,而两个氧原子位于两平面的交线上.下列有关说法正确的是( )
过氧化氢(H2O2)被称为绿色氧化剂,其分子结构如图所示.两个氢原子位于不重合的两个平面上,而两个氧原子位于两平面的交线上.下列有关说法正确的是( )
 过氧化氢(H2O2)被称为绿色氧化剂,其分子结构如图所示.两个氢原子位于不重合的两个平面上,而两个氧原子位于两平面的交线上.下列有关说法正确的是( )
过氧化氢(H2O2)被称为绿色氧化剂,其分子结构如图所示.两个氢原子位于不重合的两个平面上,而两个氧原子位于两平面的交线上.下列有关说法正确的是( )| A. | 过氧化氢分子中含有H-H键、O-O键 | |
| B. | 过氧化氢分子中存在离子键和共价键 | |
| C. | 过氧化氢分子中只有共价键,其电子式为 | |
| D. | H2O2与H2O互为同位素 |
5.下列化学用语正确的是( )
| A. | 氟化氢的电子式: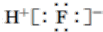 | B. | 中子数为21的钾原子:${\;}_{19}^{40}$K | ||
| C. | NH3的结构式: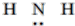 | D. | N3-的结构示意图: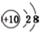 |
12.两种气态烃的混合物共1mol,在空气中完全燃烧生成2mol CO2气体和2.5mol水蒸气(气体体积均在相同状况下测定),关于该混合气体的说法正确的是( )
| A. | 一定含有乙烯 | |
| B. | 可能为等物质的量甲烷和丙烯的混合物 | |
| C. | 可能为乙烷和丙烷的混合物 | |
| D. | 一定为乙烯和甲烷的混合物 |
8.下列说法中不正确的是( )
| A. | 酸与醇反应一定能生成酯,且酯化反应是可逆反应 | |
| B. | CO2通入饱和苯酚钠溶液,用分液法可以得到苯酚 | |
| C. | 有机物  的n溴代物的同分异构体的数目与m溴代物的同分异构体的数目相等,则m、n一定满足的关系式m+n=6 的n溴代物的同分异构体的数目与m溴代物的同分异构体的数目相等,则m、n一定满足的关系式m+n=6 | |
| D. | 等物质的量的烃或烃的含氧衍生物A和B完全燃烧时,消耗氧气的量相等.则A和B的分子量相差可能为18n或44n(n为正整数) |
6.下列有关水的叙述中,可以用氢键的知识来解释的是( )
| A. | 水比硫化氢气体稳定 | B. | 水的熔沸点比硫化氢高 | ||
| C. | 氯化氢气体易溶于水 | D. | 过氧化氢易分解 |
 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
.