题目内容
13.在一定条件下MO3-与M-发生反应;MO3-+5M-+6H+═3M2+3H2O,则下列关于M元素的叙述中正确的是( )| A. | M的氢化物的水溶液呈酸性 | B. | M2在常温常压下一定是气体 | ||
| C. | MO3-中的M元素只能被还原 | D. | M位于元素周期表的第VA族 |
分析 由反应方程式可知,M的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价;则M为卤族元素但F元素除外,处于中间价态的元素具有氧化性和还原性,常温常压下,氯气是气体、溴是液体、碘是固体,据此分析解答.
解答 解:A.F元素没有正化合价,所以M不能为F元素,可以为Cl、Br、I等,其氢化物HX水溶液均显酸性,故A正确;
B.若M为Cl,单质为气体,若M为I或Br也可以发生如上反应,碘为固体,溴为液体,故B错误;
C.M的最低负价为-1,M最高正价为+7价,MO3-中M为+5价,处于中间价态,既具有氧化性又具有还原性,故C错误;
D.由反应方程式可知,M的最低负价为-1,则其最高正价为+7价,族序数等于最高正化合价,元素M应位于第ⅦA族,故D错误;
故选A.
点评 本题考查氧化还原反应及卤素性质,难度中等,关键根据离子方程式判断M的最低负价为-1,最高正价为+7价,是对所学知识的综合运用与能力考查.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
4.同温同压下,体积相同的两个容器,一个充满NO,另外一个充满N2 和O2的混合气体,这两个容器中一定相同的是( )
| A. | 原子总数 | B. | 质子总数 | C. | 电子总数 | D. | 质量 |
1.下列各组物质中,化学键完全相同的是( )
| A. | NaCl和NaOH | B. | Cl2和N2O | C. | Na2S和(NH4)2S | D. | H2O2和Na2O2 |
8. 过氧化氢(H2O2)被称为绿色氧化剂,其分子结构如图所示.两个氢原子位于不重合的两个平面上,而两个氧原子位于两平面的交线上.下列有关说法正确的是( )
过氧化氢(H2O2)被称为绿色氧化剂,其分子结构如图所示.两个氢原子位于不重合的两个平面上,而两个氧原子位于两平面的交线上.下列有关说法正确的是( )
 过氧化氢(H2O2)被称为绿色氧化剂,其分子结构如图所示.两个氢原子位于不重合的两个平面上,而两个氧原子位于两平面的交线上.下列有关说法正确的是( )
过氧化氢(H2O2)被称为绿色氧化剂,其分子结构如图所示.两个氢原子位于不重合的两个平面上,而两个氧原子位于两平面的交线上.下列有关说法正确的是( )| A. | 过氧化氢分子中含有H-H键、O-O键 | |
| B. | 过氧化氢分子中存在离子键和共价键 | |
| C. | 过氧化氢分子中只有共价键,其电子式为 | |
| D. | H2O2与H2O互为同位素 |
18.下列说法正确的是( )
| A. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| B. | 伴有能量变化的物质变化都是化学变化 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 在一个确定的化学反应中,反应物的总能量总是高于生成物的总能量 |
5.下列化学用语正确的是( )
| A. | 氟化氢的电子式: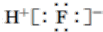 | B. | 中子数为21的钾原子:${\;}_{19}^{40}$K | ||
| C. | NH3的结构式: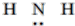 | D. | N3-的结构示意图: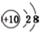 |