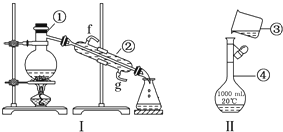
��Ŀ����
17����̼�������Ե��ܺġ�����Ⱦ�����ŷ�Ϊ�����ľ���ģʽ����̼ѭ������Ϊ��ѧ���о�����Ҫ���⣮����п�ѧ��������룺�ѿ������뱥��̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ����������ѧ��Ӧ��ʹ֮��Ϊ������ȼ�ϼ״����ù��뼼��������ͼ1��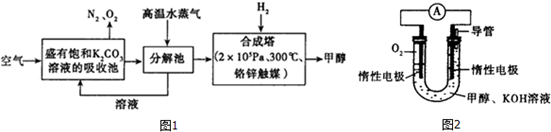
��1����ֽ����ͨ�����ˮ�������������ṩ���»���ʹKHCO3�ֽ⣮
��2����֪�ڳ��³�ѹ�£���2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=-1275.6kJ•mol-1
��2CO��g��+O2��g��=2CO2��g����H=-566.0kJ•mol-1
��H2O��g��=H2O��l����H=-44.0kJ•mol-1
��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪCH3OH��l��+O2��g��=CO ��g��+2H2O��l����H=-442.8KJ/mol��
��3�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ2��ʾ�ĵ��װ�ã���װ�ø����ĵ缫��ӦʽΪCH3OH+8OH--6e-=CO32-+6H2O��
��4����֪Ksp��CaCO3��=2.8��10-9mol2•L-2���ֽ�CaCl2��Һ��0.02mol•L-1Na2CO3��Һ�������ϣ�����CaCO3����ʱ������CaCl2��Һ����С���ʵ���Ũ��Ϊ5.6��10-7mol/L��
��5��CO��g����H2O��g����һ�������·�Ӧ�ɵõ����ȼ��H2������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������з�����Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g������ͬ�¶��µõ��������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������Ҫ��ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
��ʵ��2������ƽ�ⳣ��K=0.17��
�۸÷�Ӧ�ġ�H��0 �����������=����
���� ��1��KHCO3�����ֽ⣻
��2�������Ȼ�ѧ����ʽ��˹���ɼ���õ���
��3���״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã��״��ڸ���ʧ���ӷ���������Ӧ�������������õ������������������ӣ�����ԭ���ԭ��������д�缫��Ӧ��
��4��Na2CO3��Һ��Ũ��Ϊ0.02mol/L���������Ϻ���Һ��c��CO32-��=0.01mol/L������Ksp=c��CO32-��•c��Ca2+���������ʱ�����Һ��c��Ca2+����ԭ��ҺCaCl2��Һ����СŨ��Ϊ�����Һ��c��Ca2+����2����
��5���ٸ���v=$\frac{��c}{��t}$���㷴Ӧ���ʣ�
�ڸ���ƽ�ⳣ������ʽ�����ʵ��2��ƽ�ⳣ����
�۸����¶ȱ仯��ƽ��ʱ������������ʵ����Ķ����ж�ƽ���ƶ��ķ����жϷ�Ӧ�ȵķ��ţ�
��� �⣺��1��KHCO3�����ֽ⣬��ֽ����ͨ�����ˮ�������ṩ���»���ʹKHCO3�ֽ⣬
�ʴ�Ϊ���ṩ���»���ʹKHCO3�ֽ⣻
��2����2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H=-1275.6kJ/mol
��2CO��g��+O2��g��=2CO2��g����H=-566.0kJ/mol
��H2O��g��=H2O��l����H=-44.0kJ/mol
���ݸ�˹���ɢ�-��+�ۡ�4�õ��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��2CH3OH��l��+2O2��g��=2CO ��g��+4H2O��l����H=-885.6KJ/mol��
�õ��Ȼ�ѧ����ʽΪ��CH3OH��l��+O2��g��=CO ��g��+2H2O��l����H=-442.8KJ/mol��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO ��g��+2H2O��l����H=-442.8KJ/mol��
��3���״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã��״��ڸ���ʧ���ӷ���������Ӧ��CH3OH+8OH--6e-=CO32-+6H2O��
�ʴ�Ϊ��CH3OH+8OH--6e-=CO32-+6H2O��
��4��Na2CO3��Һ��Ũ��Ϊ0.02mol/L���������Ϻ���Һ��c��CO32-��=$\frac{1}{2}$��0.02mol/L=0.01mol/L������Ksp=c��CO32-��•c��Ca2+��=2.8��10-9��֪��c��Ca2+��=$\frac{2.8��1{0}^{-9}}{0.01}$mol/L=2.8��10-7mol/L��ԭ��ҺCaCl2��Һ����СŨ��Ϊ�����Һ��c��Ca2+����2������ԭ��ҺCaCl2��Һ����СŨ��Ϊ2��2.8��10-7mol/L=5.6��10-7mol/L��
�ʴ�Ϊ��5.6��10-7mol/L��
��5����v��CO2��=v��CO��=$\frac{4mol-2.4mol}{2L��6min}$=0.13 mol/��L��min�����ʴ�Ϊ��0.13 mol/��L��min����
��ʵ��2�дﵽƽ��ʱ��c��CO2��=c��H2��=$\frac{0.4mol}{2L}$=0.2mol/L��c��CO��=$\frac{1.6mol}{2L}$=0.8mol/L��c��H2O��=$\frac{1mol-0.4mol}{2L}$=0.3mol/L��
K=$\frac{0.2��0.2}{0.8��0.3}$��0.17��
�ʴ�Ϊ��0.17��
�۸���CO��g��+H2O��g��?CO2��g��+H2��g����֪ѹǿ��ƽ���ƶ���Ӱ�죬�����650�棬H2O��CO�����ʵ�����Ϊ1mol��2mol���ﵽƽ��ʱCO�����ʵ���ӦΪ1.2mol����900��ʱCO�����ʵ���ӦΪ1.6mol��˵�������¶�ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ������H��0��
�ʴ�Ϊ������
���� ���⿼���˸�˹���ɵ�Ӧ�á�ԭ���ԭ������Ӧ���ʵļ��㡢ƽ�ⳣ���ļ��������á��ܶȻ����йؼ���ȣ���Ŀ�ۺ��Խ�ǿ���Ƕ�ѧ�������Ŀ��飬�Ѷ��еȣ�ע����շ�Ӧԭ�����й����ݣ�

 �������⣨H2O2������Ϊ��ɫ������������ӽṹ��ͼ��ʾ��������ԭ��λ�ڲ��غϵ�����ƽ���ϣ���������ԭ��λ����ƽ��Ľ����ϣ������й�˵����ȷ���ǣ�������
�������⣨H2O2������Ϊ��ɫ������������ӽṹ��ͼ��ʾ��������ԭ��λ�ڲ��غϵ�����ƽ���ϣ���������ԭ��λ����ƽ��Ľ����ϣ������й�˵����ȷ���ǣ�������| A�� | ������������к���H-H����O-O�� | |
| B�� | ������������д������Ӽ����ۼ� | |
| C�� | �������������ֻ�й��ۼ��������ʽΪ | |
| D�� | H2O2��H2O��Ϊͬλ�� |
| A�� | ���봼��Ӧһ��������������������Ӧ�ǿ��淴Ӧ | |
| B�� | CO2ͨ�뱥�ͱ�������Һ���÷�Һ�����Եõ����� | |
| C�� | �л���  ��n������ͬ���칹�����Ŀ��m������ͬ���칹�����Ŀ��ȣ���m��nһ������Ĺ�ϵʽm+n=6 ��n������ͬ���칹�����Ŀ��m������ͬ���칹�����Ŀ��ȣ���m��nһ������Ĺ�ϵʽm+n=6 | |
| D�� | �����ʵ������������ĺ���������A��B��ȫȼ��ʱ����������������ȣ���A��B�ķ�����������Ϊ18n��44n��nΪ�������� |
| PCl3��g�� | Cl2��g�� | PCl5��g�� | |
| ��ʼŨ�ȣ�mol/L�� | 2.0 | 1.0 | 0 |
| ƽ��Ũ�ȣ�mol/L�� | c1 | c2 | 0.4 |
| A�� | 10 min�ڣ�v��Cl2��=0.04 mol/��L•min�� | |
| B�� | ��������Cl2Ϊ1.2 molʱ����Ӧ�ﵽƽ�� | |
| C�� | �����¶ȣ�T1��T2������Ӧ��ƽ�ⳣ����С��ƽ��ʱPCl3��$\frac{��n��{T}_{1}��}{��n��{T}_{2}��}$��1 | |
| D�� | ƽ�������2.0 mol PCl3��1.0 molCl2������ͬ�������ٴ�ƽ��ʱ��c��PCl5����0.2 mol/L |
| A�� | ˮ�����������ȶ� | B�� | ˮ���۷е������� | ||
| C�� | �Ȼ�������������ˮ | D�� | ���������ֽ� |
| A�� | ���������·ֽ� | B�� | ������ڵ������� | ||
| C�� | ��������������ԭ������ | D�� | �������ý�̿��ԭ������ |