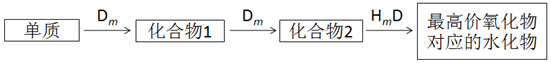
题目内容
13.下列说法正确的是( )| A. | H2和D2互为同位素 | |
| B. | 12C原子是指质子数为6,中子数是12的一种核素 | |
| C. | 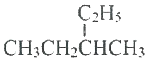 的名称是2-乙基丁烷 的名称是2-乙基丁烷 | |
| D. | 分子式为C2H6O、C4H10的有机物均有两种同分异构体 |
分析 A.质子数相同、中子数不同的原子互为同位素;
B.12C中质量数为12,质量数=质子数+中子数;
C.2号碳上不能有乙基;
D.醇和醚是同分异构体,根据烷烃的碳链异构判断.
解答 解:A.质子数相同、中子数不同的原子互为同位素,H2和D2是分子,不是原子,不是同位素,故A错误;
B.12C中质量数为12,质量数=质子数+中子数,则中子数=12-6=6,故B错误;
C.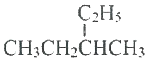 的主链上有5个碳,其名称是3-甲基戊烷,故C错误;
的主链上有5个碳,其名称是3-甲基戊烷,故C错误;
D.分子式为C2H6O的同分异构体有CH3CH2OH、CH3OCH3,C4H10的同分异构体为CH3CH2CH2CH3、CH3CH(CH3)2,故D正确.
故选D.
点评 本题考查同位素的概念、中子数的计算、有机物的命名、同分异构体,题目难度不大,明确质量数、质子数和中子数的关系、以及同位素、同分异构体的概念是解本题关键,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如表:
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量小于(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量.
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器①中反应的平衡常数K=1.某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正小于V逆(填大于,小于或等于)
(4)下列叙述正确的是ad(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如表:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器①中反应的平衡常数K=1.某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正小于V逆(填大于,小于或等于)
(4)下列叙述正确的是ad(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.
4.根据转化关系判断下列说法正确的是( )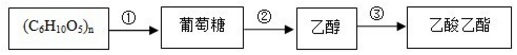

| A. | 反应②的反应类型属于分解反应 | |
| B. | (C6H10O5)n可以是淀粉或纤维素,二者互为同分异构体 | |
| C. | 将烧黑的铜丝趁热插入乙醇中可得到乙酸 | |
| D. | 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
1.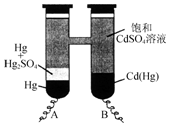 依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )
依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )
 依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )
依据Cd(Hg)+Hg2SO4═3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图.下列有关该电池的说法正确的是( )| A. | 电池工作时Cd2+向电极B移动 | |
| B. | 电极A上发生的反应:Hg2SO4+2e-═2Hg+SO42- | |
| C. | 电极B上发生的反应:Cd(Hg)-4e-═Hg2++Cd2+ | |
| D. | 反应中每生成a mol Hg转移3a mol电子 |
8.几种短周期元素的原子半径及主要化合价如表:已知X是短周期中最活泼的金属,且与R同周期.(请用化学用语答题)
(1)R的元素符号为Al; M在元素周期表中的位置为第二周期第VIA族.
(2)X与Y按原子个数比1:1构成的物质的电子式为 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.
(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+;.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH--2e-=Cu(OH)2.
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
(2)X与Y按原子个数比1:1构成的物质的电子式为
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+;.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH--2e-=Cu(OH)2.
5.A、B、C、D、E五种短周期元素,其中A是地壳中含量最多的元素;C元素的单质存在于火山喷发口附近或地壳的岩层里;E原子的电子总数等于其电子层数的3倍;D的一种原子核中没有中子;A、B、C三种元素的族序数之和为16.下列说法错误的是( )
| A. | D与E可形成既含极性键又含非极性键的分子 | |
| B. | B的最高价氧化物为酸性氧化物,不能与任何酸反应 | |
| C. | B、C、E三种元素的最高价氧化物对应的水化物中,B的酸性最弱 | |
| D. | A、C、D中两种或三种元素形成的钠盐溶液可显酸性、中性或碱性 |
15.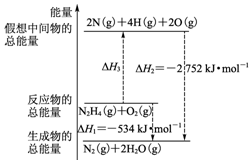 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:
火箭燃料肼(H2N-NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是( )
 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:| 化学键 | N-N | O=O | N≡N | N-H |
| 键能(kJ) | 154 | 500 | 942 | a |
| A. | N2比O2稳定 | |
| B. | N2H4(g)+O2(g)?N2(g)+2H2O(g)△H=-534 kJ•mol-1 | |
| C. | 表中的a=194 | |
| D. | 图中的△H3=+2218 kJ•mol-1 |
 配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).
配合物[Cu(CH3C≡N)4]BF4是双烯合成反应的催化剂,它被浓硝酸分解的化学方程式为:[Cu(CH3C≡N)4]BF4$\stackrel{HNO_{3}}{→}$Cu2++H3BO3+CO2↑+HF…(未配平).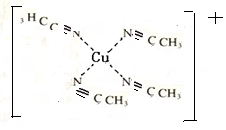 (不考虑空间构型).
(不考虑空间构型). .
. ,用电子式表示A2C的形成过程.
,用电子式表示A2C的形成过程.