题目内容
4.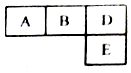 有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )
有M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37.下列说法不正确的是( )| A. | 沸点:M2D>BM3>AM4 | |
| B. | 原子半径:rE>rA>rB>rD | |
| C. | 化合物AnM2n分子中既含有极性鍵又含有非极性鍵 | |
| D. | B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4:3 |
分析 M、A、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,M为H,设A的原子序数为x,结合A、B、D、E四种元素在周期表中的相应位置图,它们的原子序数之和为37,则x+x+1+x+2+x+10=37,解得x=6,则A为C,B为N,D为O,E为S,N元素的原子半径是所在周期中最大的,结合原子序数及元素在周期表的位置可知N为第三周期元素Na,以此来解答.
解答 解:由上述分析可知,M为H,A为C,B为N,D为O,N为Na,E为S,
A.水分子间含氢键,且氢键数目比氨分子多,甲烷不含氢键,则沸点:M2D>BM3>AM4,故A正确;
B.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:rE>rA>rB>rD,故B正确;
C.化合物AnM2n分子中既含有C-H极性鍵又含有C-H非极性鍵,故C正确;
D.B元素的氢化物与D元素的单质在一定条件下能发生置换反应,为4NH3+3O2$\frac{\underline{催化剂}}{△}$2N2+6H2O,O元素的化合价降低、N元素的化合价升高,则氧化剂与还原剂的物质的量之比为3:4,故D错误;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、元素的位置、元素的性质来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
15. 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:
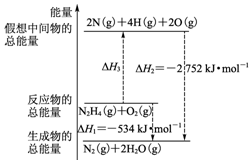
火箭燃料肼(H2N-NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是( )
 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:| 化学键 | N-N | O=O | N≡N | N-H |
| 键能(kJ) | 154 | 500 | 942 | a |
| A. | N2比O2稳定 | |
| B. | N2H4(g)+O2(g)?N2(g)+2H2O(g)△H=-534 kJ•mol-1 | |
| C. | 表中的a=194 | |
| D. | 图中的△H3=+2218 kJ•mol-1 |
9.下列说法正确的是( )
| A. | ${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C三种核素互为同素异形体 | |
| B. | 苯甲醇和邻甲基苯酚的分子式相同,化学性质也相同 | |
| C. | 等质量的甲烷按a、b两种途径完全转化,途径a比途径b消耗更多的O2 途径a:CH4$→_{催化重整}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O;途径b:CH4$→_{燃烧}^{O_{2}}$CO2+H2O | |
| D. | 铁表面镀铜时,铜与电源的正极相连,铁与电源的负极相连 |
16.短周期元素X、Y、Z、W的原子序数依次增大;X与Y、W可分别形成10e-、18e-的化合物甲和化合物乙,甲为非电解质,乙为强电解质,甲与乙常温下可化合得到离子化合物丙.X、Y、Z的最外层电子数之和等于W的最外层电子数.则下列说法正确的是( )
| A. | 化合物甲比乙的沸点低 | |
| B. | X、Y、Z、W的简单离子半径大小为:W>Y>Z>X | |
| C. | 丙属于正盐,其水溶液呈中性 | |
| D. | X和Z形成的二元化合物与乙的化学键类型相同 |
13.如图是元素周期表的一部分
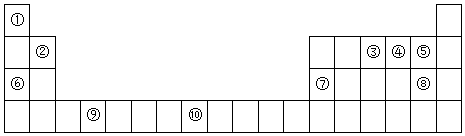
(1)元素⑩原子结构示意图为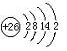 .
.
(2)元素 ③④⑤的电负性由大到小的顺序为F>O>N(填化学用语,下同),其简单离子半径由大到小的顺序为N3->O2->F-.⑤与⑧气态氢化物中稳定性较强的是HF.
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式2OH-+BeO=BeO22-+H2O
(4)根据下列五种元素的第一至第四电离能数据(单位:KJ•mol-1),回答下面各题:
①在周期表中,最可能处于同一主族的是R和U.(填元素代号)
②T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(5)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有4个硅原子,4个碳原子,其中硅原子的杂化方式为sp3.

(1)元素⑩原子结构示意图为
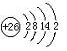 .
.(2)元素 ③④⑤的电负性由大到小的顺序为F>O>N(填化学用语,下同),其简单离子半径由大到小的顺序为N3->O2->F-.⑤与⑧气态氢化物中稳定性较强的是HF.
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的单质及其化合物有相似的性质.写出元素②的最高价氧化物与NaOH溶液反应的离子方程式2OH-+BeO=BeO22-+H2O
(4)根据下列五种元素的第一至第四电离能数据(单位:KJ•mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
②T元素最可能是p(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为120°.
(5)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有4个硅原子,4个碳原子,其中硅原子的杂化方式为sp3.
14.下列事实中,能说明HNO2是弱电解质的是( )
| A. | HNO2溶液用水稀释后,H+浓度下降 | |
| B. | HNO2溶液的导电性比盐酸弱 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 0.lmol•L-1的HNO2溶液的c(H+)=l0-2mol/L |
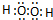 .
. ,用电子式表示A2C的形成过程.
,用电子式表示A2C的形成过程.
 ,它是一种非极性分子.(填“极性”或“非极性”)
,它是一种非极性分子.(填“极性”或“非极性”)