题目内容
5.下列化学用语表达正确的是( )| A. | F-的原子结构示意图: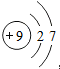 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 葡萄糖的分子式:C6H12O6 | D. | 二氧化碳的电子式: |
分析 A.F-核外电子数比质子数多1个;
B.碳碳双键在书写结构简式时,不能省略;
C.葡萄糖分子含有6个C,6个O,12个H;
D.二氧化碳分子中两个C分别于O形成1个C=O而达到8电子稳定结构;
解答 解:A.F-的原子结构示意图: ,故A错误;
,故A错误;
B.乙烯的结构简式:CH2=CH2,故B错误;
C.葡萄糖分子含有6个C,6个O,12个H,分子式:C6H12O6,故C正确;
D.二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为: ,故D错误;
,故D错误;
故选:C.
点评 本题考查了常见化学用语的使用,明确原子结构示意图、电子数、结构简式、分子式书写方法和注意事项是解题关键,注意有机物中碳碳双键、三键在书写结构简式时不能省略,题目难度不大,有利于学生养成规范使用化学用语的习惯.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
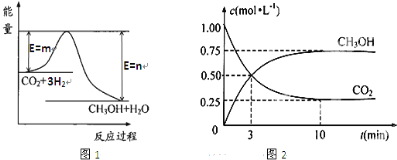
16.甲醇(CH3OH)是重要的基础有机原料.
用CO和H2制甲醇的反应:CO(g)+2H2(g)?CH3OH (g)△H=-99kJ•mol-1
的能量变化,计算x=b+c+3d-2a-99.(用含a、b、c、d的代数式表示)
(2)在容积为1L的恒容容器中,分别研究在T1、T2、T3三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率α(CO)的关系如图1所示:
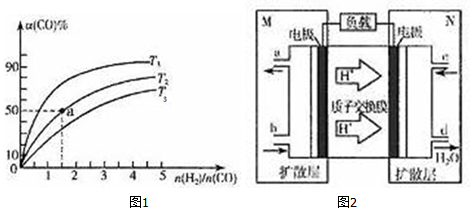
①T1、T2、T3中,温度最高的是T3.
②利用图中a点对应的数据,计算该反应在T2温度下的平衡常数K=4L2•mol-2.
若改变条件c(填序号),可使K=6L2•mol-2,
a.增大压强 b增大反应物的浓度
c.降低温度 d.减小$\frac{n({H}_{2})}{n(CO)}$
(3)用甲醇作燃料电池,其工作原理如图2所示.
①M区发生反应的电极反应式CH3OH+H2O-6e-=CO2+6H+.
②维持电流强度为0.5A,电池工作10分钟,理论上消耗甲醇$\frac{0.5×600}{96500×6}×32$g.(已知F=96500C•mol-1,写出计算表达式即可)
用CO和H2制甲醇的反应:CO(g)+2H2(g)?CH3OH (g)△H=-99kJ•mol-1
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能/kJ.mol-1 | a | b | x | c | d |
(2)在容积为1L的恒容容器中,分别研究在T1、T2、T3三种温度下合成甲醇的规律.上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率α(CO)的关系如图1所示:

①T1、T2、T3中,温度最高的是T3.
②利用图中a点对应的数据,计算该反应在T2温度下的平衡常数K=4L2•mol-2.
若改变条件c(填序号),可使K=6L2•mol-2,
a.增大压强 b增大反应物的浓度
c.降低温度 d.减小$\frac{n({H}_{2})}{n(CO)}$
(3)用甲醇作燃料电池,其工作原理如图2所示.
①M区发生反应的电极反应式CH3OH+H2O-6e-=CO2+6H+.
②维持电流强度为0.5A,电池工作10分钟,理论上消耗甲醇$\frac{0.5×600}{96500×6}×32$g.(已知F=96500C•mol-1,写出计算表达式即可)
20.二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
回答下列问题:
(1)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-245.6kJ/mol,化学平衡常数的表达式K=K=K12.K2.K3
(2)普通工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动.
(3)以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,
其CO的平衡转化率随温度、压强变化关系如图所示:
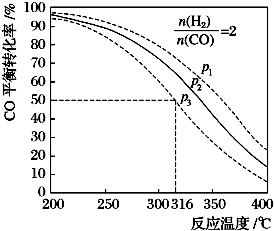
则该反应的△H<0(填“>”或“<”或“=”),在P3和316℃反应达到平衡时,H2的转化率等于50%,图中压强的大小关系为P1>P2>P3,理由是增大压强平衡正向移动CO转化率增大.
(4)以二甲醚(CH3OCH3)为原料设计电池,一个电极通入空气,另一个电极通入二甲醚蒸气,KOH溶液为电解质,则该电池的负极反应式为CH3OCH3-12e-+16OH -=2CO32-+11H2O .
| 编号 | 热化学方程式 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 |
(1)该工艺的总反应为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H
该反应△H=-245.6kJ/mol,化学平衡常数的表达式K=K=K12.K2.K3
(2)普通工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生.该工艺中反应③的发生提高了CH3OCH3的产率,原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动.
(3)以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,
其CO的平衡转化率随温度、压强变化关系如图所示:

则该反应的△H<0(填“>”或“<”或“=”),在P3和316℃反应达到平衡时,H2的转化率等于50%,图中压强的大小关系为P1>P2>P3,理由是增大压强平衡正向移动CO转化率增大.
(4)以二甲醚(CH3OCH3)为原料设计电池,一个电极通入空气,另一个电极通入二甲醚蒸气,KOH溶液为电解质,则该电池的负极反应式为CH3OCH3-12e-+16OH -=2CO32-+11H2O .
10.在一定条件下,发生反应:aA(g)+bB(g)?cC(g)△H=“Q“kJ/mol,其化学平衡常数K和温度的关系如表所示:
(1)依据图表判断该反应△H< 0(填“>”或“<”).
(2)500℃,固定容器的密闭容器中,放入混合物,其始浓度为c(A)=0.25mol/L,c(B)=0.60mol/L,c(C)=0.30mol/L,则反应开始时,B的消耗速率比生成速率不能确定 (填“大”、“小”或“不能确定”).
| t℃ | 400 | 500 | 800 | 1000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
(2)500℃,固定容器的密闭容器中,放入混合物,其始浓度为c(A)=0.25mol/L,c(B)=0.60mol/L,c(C)=0.30mol/L,则反应开始时,B的消耗速率比生成速率不能确定 (填“大”、“小”或“不能确定”).
14. 在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )
在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )
 在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )
在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )| A. | p3<p4,Y轴表示A的转化率 | |
| B. | p3>p4,Y轴表示混合气体的密度 | |
| C. | p3<p4,Y轴表示B的浓度 | |
| D. | p3>p4,Y轴表示混合气体的平均摩尔质量 |
15.已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含碳元素的质量分数为72%,则混合气体中氧元素的质量分数为( )
| A. | 84% | B. | 24% | C. | 19.6% | D. | 42% |
 .
.