题目内容
用标准的盐酸滴定未知浓度的NaOH溶液,下列操作不会引起实验误差的是( )
| A、用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| B、用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定 |
| C、用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定 |
| D、用酚酞作指示剂滴至红色刚变无色时即停止加盐酸 |
考点:中和滴定
专题:
分析:根据c(碱)=
分析,以此判断浓度的误差.
| c(酸)×V(酸) |
| V(碱) |
解答:
解:A.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定,标准盐酸被稀释,浓度偏小,造成消耗的V(酸)偏大,根据c(碱)=
分析,可知c(碱)偏大,故A错误;
B.蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定,而后装入一定体积的NaOH溶液进行滴定,待测液的物质的量偏大,造成消耗的V(酸)偏大,根据c(碱)=
分析,可知c(碱)偏大,故B错误;
C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定,对V(酸)无影响,根据c(碱)=
分析,可知c(碱)不变,故C正确;
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸,造成消耗的V(酸)偏大,根据c(碱)=
分析,可知c(碱)偏大,故D错误;
故选C.
| c(酸)×V(酸) |
| V(碱) |
B.蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,后装入NaOH溶液进行滴定,而后装入一定体积的NaOH溶液进行滴定,待测液的物质的量偏大,造成消耗的V(酸)偏大,根据c(碱)=
| c(酸)×V(酸) |
| V(碱) |
C.用碱式滴定管取10.00 mL NaOH溶液放入用蒸馏水洗净的锥形瓶中,再加入适量蒸馏水进行滴定,对V(酸)无影响,根据c(碱)=
| c(酸)×V(酸) |
| V(碱) |
D.用酚酞作指示剂滴至红色刚变无色时即停止加盐酸,造成消耗的V(酸)偏大,根据c(碱)=
| c(酸)×V(酸) |
| V(碱) |
故选C.
点评:本题主要考查了中和滴定操作的误差分析,根据c(碱)=
分析是解答的关键,题目难度不大.
| c(酸)×V(酸) |
| V(碱) |

练习册系列答案
相关题目
设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A、18gNH4+中含有的电子数为10NA |
| B、常温常压下,10g氖气所含原子数为NA |
| C、1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA |
| D、标准状况下,2.24L己烷含有分子的数目为0.1NA |

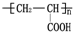 的单体,则A中所含官能团的名称是
的单体,则A中所含官能团的名称是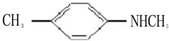 、
、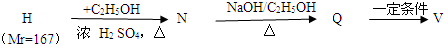

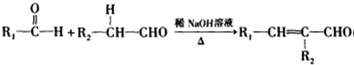 (R1、R2为烃基或氢原子);
(R1、R2为烃基或氢原子); (R1、R2为烃基)
(R1、R2为烃基) )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.
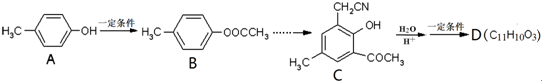
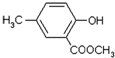 ,合成路线流程图为:
,合成路线流程图为: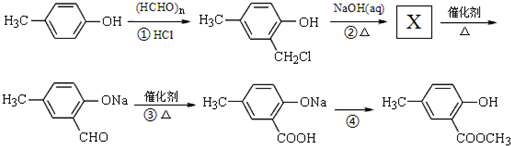
 的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)
的合成路线流程图表示(有机物用结构简式,注明反应试剂和条件)
 是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2 及
是一种合成药物的中间体,请写出以CH2(COOH)2、CH2Cl2 及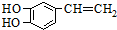 为原料制备该化合物,合成该化合物路线流程图(无机试剂任用),
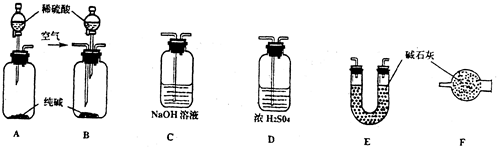
为原料制备该化合物,合成该化合物路线流程图(无机试剂任用), 工业生产的纯碱中常含有少量的NaCl等杂质.如图是测定产品中Na2CO3质量分数的实验装置.(碱石灰是一种既能吸收CO2,又能吸收H2O的物质)
工业生产的纯碱中常含有少量的NaCl等杂质.如图是测定产品中Na2CO3质量分数的实验装置.(碱石灰是一种既能吸收CO2,又能吸收H2O的物质)