题目内容
4.下列叙述中,正确的是( )| A. | 碳酸钙在水中的溶解度很小,其水溶液电阻率很大,所以它是弱电解质 | |
| B. | 碳酸钙在水中的溶解度很小,但溶于水的碳酸钙完全电离,所以碳酸钙是强电解质 | |
| C. | 氯气与氨气的水溶液导电性好,所以他们是强电解质 | |
| D. | 液态的二氧化硫不导电,但溶于水后溶液导电,所以二氧化硫是强电解质 |
分析 A、碳酸钙溶于水的部分完全电离,碳酸钙为强电解质;
B、碳酸钙溶于水的部分完全电离,碳酸钙为强电解质;
C、氯气为单质,不属于电解质和非电解质;氨气不能电离出离子;
D、水能够电离出氢离子和氢氧根离子,水为弱电解质.
解答 解:A、电解质强弱与溶液导电性没有必然关系,强弱电解质的根本区别在于能否完全电离,碳酸钙溶于水的部分完全电离,所以碳酸钙为强电解质,故A错误;
B、强弱电解质与溶解度大小没有必然关系,关键看电解质能否完全电离,碳酸钙溶于水的部分完全电离,所以碳酸钙为强电解质,故B正确;
C、氯气为单质,所以既不是电解质,也不是非电解质;氨气的水溶液导电,导电的离子是一水合氨电离的,不是氨气本身电离的,所以氨气为非电解质,故C错误;
D、液态的二氧化硫不导电,溶于水后溶液导电,但不是二氧化硫本身导电,所以二氧化硫是非电解质,故D错误,
故选B.
点评 本题考查了电解质与非电解质、强电解质与弱电解质的判断、溶液导电性强弱判断,题目难度中等,注意明确电解质与非电解质、强电解质与弱电解质的概念及根本区别,明确影响溶液导电性的根本因素、导电性与强弱电解质没有必然关系.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.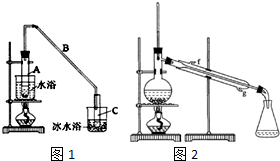 某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.
某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.
已知: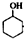 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O
+H2O
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
③浓H2SO4在反应中的作用催化剂、脱水剂.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入蒸馏水,振荡、静置、分层,环己烯在上 层(填上或下).
②再将环己烯按图2装置蒸馏,冷却水从g (填入编号)口进入.蒸馏时要加入生石灰的目的除去了残留的水.
(3)以下可以鉴别环己烯和环己醇的物质有bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水.
 某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.
某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.已知:
 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O
+H2O| 密度(g.cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.096 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.081 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
③浓H2SO4在反应中的作用催化剂、脱水剂.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入蒸馏水,振荡、静置、分层,环己烯在上 层(填上或下).
②再将环己烯按图2装置蒸馏,冷却水从g (填入编号)口进入.蒸馏时要加入生石灰的目的除去了残留的水.
(3)以下可以鉴别环己烯和环己醇的物质有bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水.
15.已知图一表示的是可逆反应CO(g)+H2(g)?C(s)+H2O(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
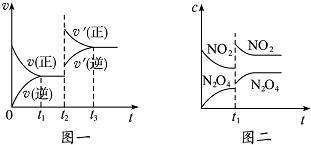

| A. | 图一t2时改变的条件可能是升高了温度或增大了压强 | |
| B. | 图一t2时改变的条件是增大压强,则反应的△H增大 | |
| C. | 图二t1时改变的条件可能是升高了温度 | |
| D. | 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
9.配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是( )
| A. | 容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液 | |
| B. | 配制一定物质的量浓度的稀盐酸时,用量筒量取9.82 mL浓盐酸 | |
| C. | 配制1 L 0.1 mol•L-1的NaCl溶液时用托盘天平称量5.85 g NaCl固体 | |
| D. | 定容时,为防止液滴飞溅,胶头滴管紧贴容量瓶内壁 |
12.乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中不正确的是( )
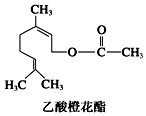

| A. | 分子式为C12H20O2 | |
| B. | 1 mol该有机物水解时只能消耗1 mol NaOH | |
| C. | 1mol该有机物可消耗3molH2 | |
| D. | 不能发生银镜反应 |
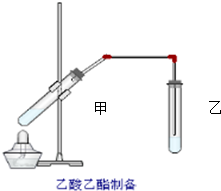 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
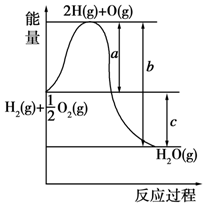 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,请回答下列问题.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,请回答下列问题.