题目内容
19.某CuS样品含少量不溶于酸的杂质,实验室以该样品为原料制备CuCl2•2H2O晶体.流程如图所示: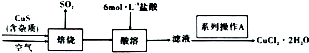
已知:CuS在高温煅烧过程中,有下列所示的转化关系:CuS$\stackrel{Ⅰ}{→}$Cu2S$\stackrel{Ⅱ}{→}$CuO•CuSO4$\stackrel{Ⅲ}{→}$CuSO4$→_{760℃}^{Ⅳ}$CuO
(1)写出CuS在高温煅烧第I阶段的化学反应方程式:2CuS+O2$\frac{\underline{\;高温\;}}{\;}$SO2+Cu2S
(2)写出酸溶时发生的主要离子方程式:CuO+2H+=Cu2++H2O.
(3)系列操作A包括ba (填序号).
a.过滤 b.燕发浓缩、冷却结晶 c.分液 d.灼烧
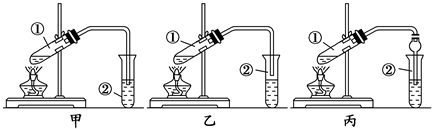
(4)实验室模拟焙烧CuS的第IV阶段过程,并验证所得气体中有SO2和O2,如图(已知:浓硫酸可吸收SO3气体)
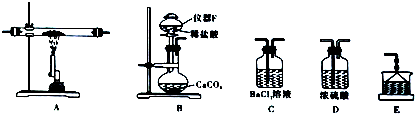
①装置的正确连接顺序是B→D→A→D→C→E(填装置字毋代号,有的装置可重复使用);装置连接后,应立即进行的一项操作是检查装置气密性.
②装置B的作用是制得二氧化碳气体,排除装置内空气,其中仪器F的名称为分液漏斗;装置E的试剂是NaOH溶液.
③能验证所得气体中有SO2和O2的现象是C中产生白色沉淀.
④若原CuS样品质量为12g,在实验过程中保持760℃持续加热充分反应(杂质不参与反应),石英玻璃管内所得固体的质童为10.28g,则样品中CuS的质量分数为86%.
分析 CuS在焙烧过程中发生氧化还原反应,依次有Cu2S、CuO•CuSO4、CuSO4、CuO生成,硫化铜中的硫最终转化成二氧化硫,同时生成CuO,加入盐酸,盐酸和CuO反应生成氯化铜,过滤得到氯化铜溶液,经蒸发浓缩、冷却结晶得到产品;
(1)CuS在高温煅烧第I阶段生成Cu2S和SO2,根据反应物和生成物及反应条件书写该反应的化学反应方程式;
(2)CuO和稀盐酸反应生成氯化铜和水;
(3)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤的方法;
(4)硫酸铜受热分解所得气体的成分可能含有SO3、SO2、O2,验证所得气体中有SO2和O2,需排尽A装置中的空气,用装置B制取干燥的二氧化碳,先通入二氧化碳排尽A中的空气,再对A进行加热,用浓硫酸吸收水和三氧化硫,进入氯化钡溶液的气体只有二氧化硫和氧气,当氯化钡中产生白色沉淀,说明所得气体有有SO2和O2,再用E进行尾气吸收;
①由分析可知实验装置的正确连接顺序;实验前必须检查装置的气密性;
②装置B的作用是制得二氧化碳气体,排除装置内空气;F仪器名称是分液漏斗;二氧化硫有毒,且是酸性氧化物,可用氢氧化钠溶液吸收;
③只有二氧化硫通入氯化钡溶液时,不发生反应,无明显现象,若同时有氧气通入,会发生氧化还原反应生成硫酸钡沉淀;
④硫化铜中有不反应的杂质,反应前是CuS和杂质12g,最终是CuO和杂质10.28g,质量差为12g-10.28g=1.72,等于硫元素与氧元素的质量差,则CuS物质的量应为0.1075mol,计算出其质量,再算出质量分数.
解答 解:CuS在焙烧过程中发生氧化还原反应,依次有Cu2S、CuO•CuSO4、CuSO4、CuO生成,硫化铜中的硫最终转化成二氧化硫,同时生成CuO,加入盐酸,盐酸和CuO反应生成氯化铜,过滤得到氯化铜溶液,经蒸发浓缩、冷却结晶得到产品;
(1)CuS在高温煅烧第I阶段生成Cu2S和SO2,根据反应物和生成物及反应条件书写该反应的化学反应方程式为2CuS+O2$\frac{\underline{\;高温\;}}{\;}$SO2+Cu2S,
故答案为:2CuS+O2$\frac{\underline{\;高温\;}}{\;}$SO2+Cu2S;
(2)CuO和稀盐酸反应生成氯化铜和水,离子方程式为CuO+2H+=Cu2++H2O,
故答案为:CuO+2H+=Cu2++H2O;
(3)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤的方法,所以A包含蒸发浓缩、冷却结晶和过滤,故选ba;
(4)硫酸铜受热分解所得气体的成分可能含有SO3、SO2、O2,验证所得气体中有SO2和O2,需排尽A装置中的空气,用装置B制取干燥的二氧化碳,先通入二氧化碳排尽A中的空气,再对A进行加热,用浓硫酸吸收水和三氧化硫,进入氯化钡溶液的气体只有二氧化硫和氧气,当氯化钡中产生白色沉淀,说明所得气体有有SO2和O2,再用E进行尾气吸收;
①由分析可知实验装置的正确连接顺序是B→D→A→D→C→E,反应装置有多个仪器组合而成,实验前必须检查装置的气密性,
故答案为:A;D;C;E;检查装置气密性;
②装置B的作用是制得二氧化碳气体,排除装置内空气;F为分液漏斗;二氧化硫有毒,污染空气,可用氢氧化钠溶液吸收,则E中的试剂是氢氧化钠溶液,
故答案为:制得二氧化碳气体,排除装置内空气;分液漏斗;氢氧化钠溶液;
③只有二氧化硫通入氯化钡溶液时,不发生反应,无明显现象,若同时有氧气通入,会生成硫酸钡沉淀,所以当C中有白色沉淀产生时,说明产生的气体中有二氧化硫和氧气,
故答案为:C中产生白色沉淀;
④硫化铜中有不反应的杂质,反应前是CuS和杂质12g,最终是CuO和杂质10.4g,质量差为12g-10.28g=1.72g,等于硫元素与氧元素的质量差,则n(CuS)=0.10750.1mol,质量为0.1075mol×96g/mol=10.32g,质量分数为$\frac{10.32g}{12g}$×100%=86%,
故答案为:86%.
点评 本题考查物质制备方法、性质实验方案设计等,最后的质量分数计算是难点,容易忽略“杂质不参加反应“,错误认为10.4g就是氧化铜的质量,试题培养了学生的分析、理解能力及灵活应用所学知识的能力,易错点是实验装置排列顺序判断,题目难点中等.

 阅读快车系列答案
阅读快车系列答案| A. | 碳酸钙在水中的溶解度很小,其水溶液电阻率很大,所以它是弱电解质 | |
| B. | 碳酸钙在水中的溶解度很小,但溶于水的碳酸钙完全电离,所以碳酸钙是强电解质 | |
| C. | 氯气与氨气的水溶液导电性好,所以他们是强电解质 | |
| D. | 液态的二氧化硫不导电,但溶于水后溶液导电,所以二氧化硫是强电解质 |
| A. | 电解质电离 | B. | Na2CO3水解 | C. | 物质溶解 | D. | 强酸与强碱反应 |
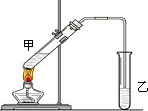 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: .
.
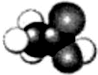 乙酸是食醋的主要成分,它的分子结构模型如图所示.
乙酸是食醋的主要成分,它的分子结构模型如图所示.
 CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;