题目内容
15.已知图一表示的是可逆反应CO(g)+H2(g)?C(s)+H2O(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )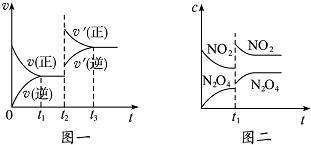
| A. | 图一t2时改变的条件可能是升高了温度或增大了压强 | |
| B. | 图一t2时改变的条件是增大压强,则反应的△H增大 | |
| C. | 图二t1时改变的条件可能是升高了温度 | |
| D. | 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
分析 A.应CO(g)+H2(g)?C(s)+H20(g)△H>0,正反应是气体体积减小吸热反应,升高温度或增大压强,正逆速率都增大,平衡向正反应方向移动,正反应速率增大更多;
B.学反应的焓变和压强之间没有联系;
C.应2NO2(g)?N2O4(g)△H<0,正反应是气体体积减小放热反应,增大压强,改变体积的瞬间都浓度增大,平衡向正反应方向移动,但升高温度,平衡向逆反应方向移动,改变条件的瞬间,浓度不变;.
D.图二t1时刻改变的条件是增大压强,平衡向逆反应方向移动,反应混合气体总的物质的量减小,混合气体总质量不变.
解答 解:A.CO(g)+H2(g)?C(s)+H20(g)△H>0,正反应是气体体积减小吸热反应,升高温度或增大压强,正逆速率都增大,平衡向正反应方向移动,正反应速率增大更多,图一与实际相符合,故A正确;
B.应的焓变只和反应物以及生成物的能量有关,和压强之间没有联系,故B错误;
C.应2NO2(g)?N2O4(g)△H<0,正反应是气体体积减小放热反应,增大压强,改变体积的瞬间都浓度增大,平衡向正反应方向移动,但升高温度,平衡向逆反应方向移动,改变条件的瞬间,浓度不变,图二与实际不相符,故C错误;
D.图二t1时刻改变的条件是增大压强,平衡向逆反应方向移动,反应混合气体总的物质的量减小,混合气体总质量不变,混合气体的平均相对分子质量将增大,故D正确;
故选AD.
点评 本题考查化学平衡图象、化学反应速率及化学平衡影响因素、化学平衡常数等,为高频考点,难度中等,侧重考查学生读图提取信息能力与知识迁移运用能力,注意图二中,改变温度瞬间浓度不变化.

练习册系列答案
相关题目
20.半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的 Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
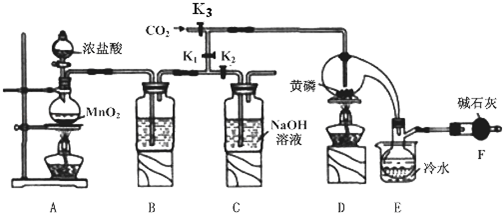
已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓硫酸,F中碱石灰的作用有两种,分别是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应.
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等,加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.

已知:
①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓硫酸,F中碱石灰的作用有两种,分别是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应.
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等,加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3溶液滴定;
④重复②、③操作平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.
4.下列叙述中,正确的是( )
| A. | 碳酸钙在水中的溶解度很小,其水溶液电阻率很大,所以它是弱电解质 | |
| B. | 碳酸钙在水中的溶解度很小,但溶于水的碳酸钙完全电离,所以碳酸钙是强电解质 | |
| C. | 氯气与氨气的水溶液导电性好,所以他们是强电解质 | |
| D. | 液态的二氧化硫不导电,但溶于水后溶液导电,所以二氧化硫是强电解质 |
5.Se、Br两种元素的部分信息如如图所示,下列说法正确的是( )


| A. | 原子半径:Br>Se | B. | 还原性:Se2-<Br- | ||
| C. | 在Se2Br2分子中只含有极性键 | D. | SeO2 既有氧化性又有还原性 |


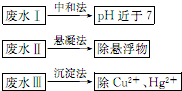 水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
 乙酸是食醋的主要成分,它的分子结构模型如图所示.
乙酸是食醋的主要成分,它的分子结构模型如图所示.