题目内容
17.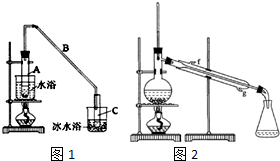 某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.
某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.已知:
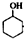 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O
+H2O| 密度(g.cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.096 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.081 | -103 | 83 | 难溶于水 |
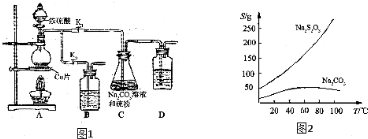
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
③浓H2SO4在反应中的作用催化剂、脱水剂.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入蒸馏水,振荡、静置、分层,环己烯在上 层(填上或下).
②再将环己烯按图2装置蒸馏,冷却水从g (填入编号)口进入.蒸馏时要加入生石灰的目的除去了残留的水.
(3)以下可以鉴别环己烯和环己醇的物质有bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水.
分析 (1)①根据制乙烯实验的知识,发生装置A中碎瓷片的作用是防止暴沸,由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝;
②冰水浴的目的是降低环己烯蒸气的温度,使其液化;
③根据 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O分析浓H2SO4在反应中的作用;
+H2O分析浓H2SO4在反应中的作用;
(2)①环己烯不溶于氯化钠溶液,且密度比水小;
②为了使冷凝的效果更好,冷却水从冷凝管的下口进入,上口出;生石灰能与水反应生成氢氧化钙;
(3)根据混合物没有固定的沸点,而纯净物有固定的沸点,据此可判断产品的纯度.
解答 解:(1)①根据制乙烯实验的知识,发生装置A中碎瓷片的作用是防止暴沸,由于生成的环己烯的沸点为83℃,要得到液态环己烯,导管B除了导气外还具有冷凝作用,便于环己烯冷凝,
故答案为:防止暴沸;冷凝;
②冰水浴的目的是降低环己烯蒸气的温度,使其液化,故答案为:进一步冷却,防止环己烯挥发;
③根据 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O,则浓H2SO4在反应中的作用催化剂、脱水剂,故答案为:催化剂、脱水剂;
+H2O,则浓H2SO4在反应中的作用催化剂、脱水剂,故答案为:催化剂、脱水剂;
(2)①环己烯是烃类,不溶于氯化钠溶液,且密度比水小,振荡、静置、分层后环己烯在上层,故答案为:上;
②为了使冷凝的效果更好,冷却水从冷凝管的下口即g口进入;生石灰能与水反应生成氢氧化钙,除去了残留的水,得到纯净的环己烯;
故答案为:g;除去了残留的水;
(3)区别粗品与精品可加入金属钠,观察是否有气体产生,若无气体,则是精品,另外根据混合物没有固定的沸点,而纯净物有固定的沸点,通过测定环己烯粗品和环己烯精品的沸点,也可判断产品的纯度,
故答案为:bc.
点评 本题考查了以环己醇制备环己烯的实验方法,综合考查了物质的分离方法,冷凝,产量的分析等,难度适中,考查学生解决实际问题的能力.

| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)830℃,在1L的固定容器的密闭容器中放入1mol CO和5mol H2O,反应达平衡后,其化学平衡常数K等于1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动.(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向(选填“正反应方向”、“逆反应方向”、“不移动”).
| A. | 碳酸钙在水中的溶解度很小,其水溶液电阻率很大,所以它是弱电解质 | |
| B. | 碳酸钙在水中的溶解度很小,但溶于水的碳酸钙完全电离,所以碳酸钙是强电解质 | |
| C. | 氯气与氨气的水溶液导电性好,所以他们是强电解质 | |
| D. | 液态的二氧化硫不导电,但溶于水后溶液导电,所以二氧化硫是强电解质 |
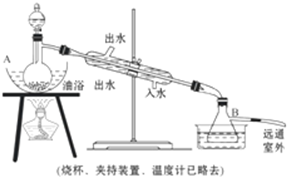
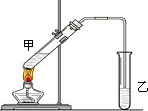 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: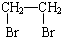 .
.
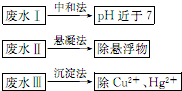 水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.