题目内容
6.写出下列反应的离子方程式①铝片与硝酸汞溶液反应2Al+3Hg2+=3Hg+2Al3+.
②向Mg Cl2溶液中滴加氨水(NH3•H2O)生成Mg(OH)2沉淀Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
分析 ①铝的金属性大于汞,可以从溶液中置换出金属汞;
②氯化镁与氨水反应生成氢氧化镁沉淀和氯化铵.
解答 解:①铝片与硝酸汞溶液反应生成硝酸铝和汞单质,反应的离子方程式为:2Al+3Hg2+=3Hg+2Al3+,
故答案为:2Al+3Hg2+=3Hg+2Al3+;
②向Mg Cl2溶液中滴加氨水(NH3•H2O)生成Mg(OH)2沉淀,反应的离子方程式为:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+,
故答案为:Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+.
点评 本题考查了离子方程式的书写,为高考的高频题,题目难度不大,明确发生反应的实质为解答关键,注意掌握离子方程式的书写原则,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
16.下列反应中不属于氧化还原反应的是( )
| A. | 3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | 3Cl2+6KOH=5KCl+KClO3+3H2O | |
| C. | 3CCl4+K2Cr2O7=2CrO2C12+3COCl2+2KCl | |
| D. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$ K2MnO4+MnO2+O2↑ |
17.有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀.对此实验下述结论正确的是( )
| A. | 加硝酸后的不溶性沉淀一定是BaSO4 | |
| B. | Na2SO3已部分被空气中的氧气氧化 | |
| C. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| D. | 此实验能确定Na2SO3是否被部分氧化 |
14.下列关于摩尔的说法中正确的是( )
| A. | 是七个基本物理量之一 | B. | 表示物质质量的单位 | ||
| C. | 表示物质中所含的粒子数 | D. | 是物质的量的单位 |
1.向含有c(FeCl3)=0.2mol•L-1、c(FeCl2)=0.1mol•L-1的混合溶液中滴加稀NaOH溶液可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是( )
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 可用过滤的方法将黑色金属氧化物与Na分离开 | |
| C. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| D. | 当光束通过该分散系时,可以看到一条光亮的“通路” |
11.下列有关氧化还原反应的叙述正确的是( )
| A. | 氧化剂被还原,还原剂被氧化 | |
| B. | 有单质参加或生成的反应一定属于氧化还原反应 | |
| C. | 失电子难的物质,获得电子的能力一定强 | |
| D. | 一种元素被氧化,肯定有另一种元素被还原 |
3.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如右图所示.下列说法正确的是( )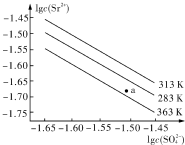

| A. | 温度一定时,KSP(SrSO4)随c(SO42-)的增大而减小 | |
| B. | 三个不同温度中,313K时KSP(SrSO4)最大 | |
| C. | 283K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
20.已知在25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.3×10-17,下列说法错误的是( )
| A. | 向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度减小 | |
| B. | 由于Ksp(AgCl)>Ksp(AgI),AgCl 沉淀在一定条件下可转化为AgI沉淀 | |
| C. | 在AgCl沉淀溶解平衡体系中加入蒸馏水,AgCl的Ksp增大 | |
| D. | 向等浓度的NaCl和NaI混合溶液中逐滴加入AgNO3溶液,先出现AgI沉淀 |

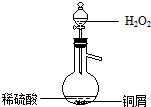 (3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.
(3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.