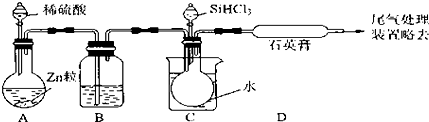
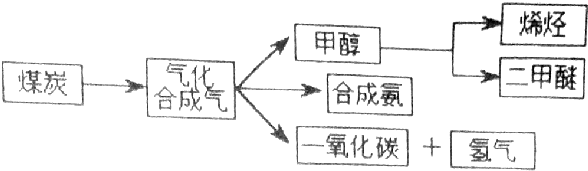
题目内容
13.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4•7H2O),过程如图: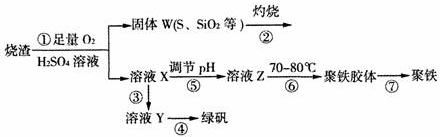
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是ACD ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(3)过程③中,需加入的物质是Fe;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有蒸发皿、玻璃棒;
(5)过程⑤调节pH可选用下列试剂中的C (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一 80℃,目的是促进Fe3+的水解.
分析 硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4?7H2O),烧渣在硫酸溶液中通入足量氧气,FeS和稀硫酸反应然后和氧气反应生成Fe2(SO4)3和S,铁的氧化物和稀硫酸、氧气反应生成Fe2(SO4)3,SiO2不反应,过滤后得到固体W(S和SiO2等),灼烧固体W,S燃烧生成SO2;滤液X中含有Fe2(SO4)3和稀硫酸,溶液Y能得到绿矾,则Y溶质为FeSO4,Fe2(SO4)3和Fe反应生成FeSO4,所以X生成Y时加入Fe粉;X调节溶液的pH得到溶液Z,加入70-80℃时得到聚铁胶体,从而得到聚铁;
(1)将过程②中的产生的气体是二氧化硫,二氧化硫具有漂白性和还原性;
(2)过程①中,FeS和O2、H2SO4反应生成硫酸铁、S和水;
(3)过程③中,需加入的物质能还原铁离子且不能引进新的杂质;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有蒸发皿、玻璃棒;
(5)过程⑤调节pH,加入的物质应该能和氢离子反应提高溶液的pH;
(6)过程⑥中,将溶液Z加热到70一 80℃,升高温度促进铁离子水解.
解答 解:硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4?7H2O),烧渣在硫酸溶液中通入足量氧气,FeS和稀硫酸反应然后和氧气反应生成Fe2(SO4)3和S,铁的氧化物和稀硫酸、氧气反应生成Fe2(SO4)3,SiO2不反应,过滤后得到固体W(S和SiO2等),灼烧固体W,S燃烧生成SO2;滤液X中含有Fe2(SO4)3和稀硫酸,溶液Y能得到绿矾,则Y溶质为FeSO4,Fe2(SO4)3和Fe反应生成FeSO4,所以X生成Y时加入Fe粉;X调节溶液的pH得到溶液Z,加入70-80℃时得到聚铁胶体,从而得到聚铁;
(1)将过程②中的产生的气体是二氧化硫,二氧化硫能使品红溶液褪色是因为二氧化硫的漂白性,能使酸性高锰酸钾溶液和溴水褪色是因为二氧化硫的还原性,二氧化硫能使紫色石蕊溶液变红色,但不能漂白指示剂,所以二氧化硫能使溶液褪色的有ACD,故选ACD;
(2)过程①中,FeS和O2、H2SO4反应生成硫酸铁、S和水,反应方程式为4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S,
故答案为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(3)过程③中,需加入的物质能还原铁离子且不能引进新的杂质,硫酸铁和Fe反应生成硫酸亚铁且不引进新的杂质,故答案为:Fe;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有蒸发皿、玻璃棒,
故答案为:蒸发皿、玻璃棒;
(5)过程⑤调节pH应使溶液碱性增强,有利于聚铁的生成,
A.加入硫酸能使溶液pH减小,故A错误;
B.加入碳酸钙生成微溶的硫酸钙,会引入新的杂质,故B错误;
C.加入NaOH可使溶液碱性增强,生成的聚铁中不引入新的杂质,故C正确;
故答案为:C;
(6)过程⑥目的为促进的水解,加热有利于水解的进行,促进Fe3+的水解,故答案为:促进Fe3+的水解.
点评 本题考查物质制备,为高频考点,侧重考查学生实验操作、对元素化合物的掌握和运用,明确流程图中发生的反应及元素化合物性质是解本题关键,涉及盐类水解、氧化还原反应、仪器的选取、除杂等知识点,注意基础知识的掌握和归纳,题目难度不大.

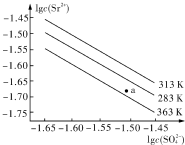
| A. | 温度一定时,KSP(SrSO4)随c(SO42-)的增大而减小 | |
| B. | 三个不同温度中,313K时KSP(SrSO4)最大 | |
| C. | 283K时,图中a点对应的溶液是饱和溶液 | |
| D. | 283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液 |
| U | |||
| W | Y |
(2)能提高W与稀硫酸反应速率的方法是bd
a.使用浓硫酸 b.加热 c.加压 d.使用等质量的W粉末
(3)在恒容密闭容器中进行:2YO2(g)+O2(g)$?_{催化剂}^{450℃}$ 2YO3(g)△H2=-190kJ/mol
①该反应 450℃时的平衡常数> 500℃时的平衡常数(填<,>或=).
②下列描述中能说明上述反应已达平衡的是abd
a.2ν(O2)正=ν(YO3)逆 b.气体的平均分子量不随时间而变化
c.反应时气体的密度不随时间而变化 d.反应时气体的分子总数不随时间而变化
③在一个固定容积为2L的密闭容器中充入0.20mol YO2和0.10molO2,半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=0.09mol/(L.min):平衡常数为16200.若继续通入0.20molYO2和0.10molO2,再次达到平衡后,YO3物质的量约为0.368mol.
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 两者的分散质微粒均能透过半透膜和滤纸 | |
| C. | 溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的“光亮的通路”,前者则没有 |
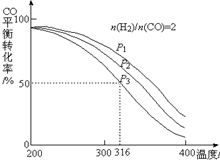 利用CO和H2还可以制备二甲醚.将合成气以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如右图所示,下列说法不正确的是B.
利用CO和H2还可以制备二甲醚.将合成气以$\frac{n({H}_{2})}{n(CO)}$=2通入1L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)△H,其CO的平衡转化率随温度、压强变化关系如右图所示,下列说法不正确的是B.
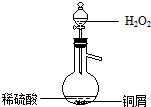 (3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.
(3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是Cu+H2O2+H2SO4=CuSO4+2H2O.