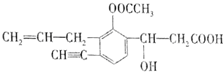
题目内容
20.某研究性学习小组成员,利用稀硫酸与某金属的反应来探究影响化学反应速率的因素,下表是研究过程中记录的实验数据(表中某些数据记录已模糊不清,个别数据已丢失).若实验操作、数据记录均是正确的,试分析上述数据回答下列问题:(1)该实验主要是探究金属表面积、硫酸溶液浓度和反应温度对反应速率的影响.
(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理.
| 实验序号 | 金属质量(g) | 金属状态 | C(H2SO4)(mol/L) | V(H2SO4)(mL) | 溶液温度(℃) | 金属消失的时间(s) | |
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 数据模糊 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 数据模糊 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 数据丢失 | 44 | 40 |
分析 (1)根据实验的条件找出相同的、不同的物理量,出现不同的物理量则是要探究的条件,金属的质量相同但状态不同,则探究其接触面积与反应速率的关系;硫酸的体积相同但浓度不同,所以考查了其浓度对反应速率的影响;溶液温度不同,所以探究温度对反应速率的影响;
(2)对比实验的异同,比较反应速率,结合外界条件对反应速率的影响可得出模糊的数据.
解答 解:(1)根据实验的条件找出相同的、不同的物理量,出现不同的物理量则是要探究的条件,金属的质量相同但状态不同,则探究其接触面积与反应速率的关系;硫酸的体积相同但浓度不同,所以考查了其浓度对反应速率的影响;溶液温度不同,所以探究温度对反应速率的影响,将三者影响因素综合考虑,可得出如下结论,金属表面积越大,反应速率越快;硫酸浓度越大,反应速率越快;温度越高,反应速率越快,
故答案为:金属表面积、硫酸溶液浓度、反应温度;
(2)实验1和3相比较,3浓度较大,反应速率较大,所用时间应小于500s,实验3和4相比较,实验3浓度较小,则所用时间应大于200s,则实验3模糊数据应为250,实验5与实验2相比较,金属表面积相等,但实验5浓度较大,反应速率应较大,则实验5时间应小于50,应为25s,实验6与实验4相比较,实验6浓度较大,反应速率较大,所用时间应小于200s,与实验8相比较,浓度较小,所用时间应大于100s,则实验6模糊数据应为125,等量的金属参加反应时,放出的热量相同,则溶液温度升高的数值应和其它实验相同,则实验7的模糊数据应为50,
故答案为:
| 实验序号 | 金属质量(g) | 金属状态 | C(H2SO4)(mol/L) | V(H2SO4)(mL) | 溶液温度(℃) | 金属消失的时间(s) | |
| 1 | |||||||
| 2 | |||||||
| 3 | 250 | ||||||
| 4 | |||||||
| 5 | 25 | ||||||
| 6 | 125 | ||||||
| 7 | 50 | ||||||
| 8 | |||||||
| 9 | 数据丢失 | ||||||
点评 本题考查化学反应速率的实验探究,本题注意分析表中数据的异同,结合浓度、温度以及固体表面积的大小进行比较,得出结论,题目难度中等.

练习册系列答案
相关题目
13.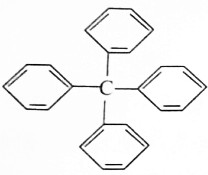 甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
对该分子的下列叙述,不正确的是( )
 甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:对该分子的下列叙述,不正确的是( )
| A. | 分子式为C25H20 | |
| B. | 所有碳原子都在同一平面上 | |
| C. | 此物质属于芳香烃类物质 | |
| D. | 该物质中既含有极性键又含有非极性键 |
8.(1)已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验一如下(所取溶液体积均为10mL):
其他条件不变时:探究温度对化学反应速率的影响,应选择实验①⑤或②④(填实验编号);
若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究比较改变不同反应物的浓度对反应速率的影响对化学反应速率的影响.
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为$\frac{3a}{5V}$ mol/(L•min).
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B(填字母序号).
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究比较改变不同反应物的浓度对反应速率的影响对化学反应速率的影响.
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为$\frac{3a}{5V}$ mol/(L•min).
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B(填字母序号).
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
12.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
已知:碳的燃烧热△H1=akJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=bkJ•mol-1
S(s)+2K(s)═K2S(s)△H2=ckJ•mol-1,则x为( )
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ•mol-1
已知:碳的燃烧热△H1=akJ•mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=bkJ•mol-1
S(s)+2K(s)═K2S(s)△H2=ckJ•mol-1,则x为( )
| A. | a+b-c | B. | c-3a-b | C. | 3a-b+c | D. | c-a-b |
9.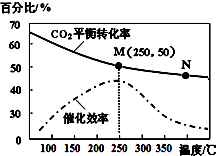 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 | |
| C. | 平衡常数:KM<KN | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为15.4% |
10.元素的性质呈周期性变化的根本原因是( )
| A. | 元素的原子核外电子排布呈周期性变化 | |
| B. | 元素主要化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的相对原子质量递增,量变引起质变 |