题目内容
9.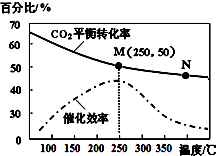 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 | |
| C. | 平衡常数:KM<KN | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为15.4% |
分析 A、温度升高化学反应速率加快,催化剂的催化效率降低;
B、根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动;
C、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动;
D、设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%,据此列三段式计算.
解答 解:A、化学反应速率随温度的升高而加快,催化剂的催化效率降低,所以v(M)有可能小于v(N),故A正确;
B、根据图象,当温度高于250℃,升高温度二氧化碳的平衡转化率减低,则平衡逆向移动,但催化剂只影响反应速率,不影响平衡移动和转化率,故B错误;
C、升高温度二氧化碳的平衡转化率减低,则升温平衡逆向移动,所以M化学平衡常数大于N,故C错误;
D、设开始投料n(H2)为3mol,则n(CO2)为1mol,所以当在M点平衡时二氧化碳的转化率为50%
所以有6H2(g)+2CO2(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H2O(g)
开始 3 1 0 0
转化 1.5 0.5 0.25 1
平衡 1.5 0.5 0.25 1
所以乙烯的体积分数为$\frac{0.25}{1.5+0.5+0.25+1}$×100%=7.7%,故D错误;
故选A.
点评 本题考查了图象分析化学反应速率的影响因素、平衡计算、平衡移动等,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
1.不属于等电子体的一组的是( )
| A. | CH4和NH4+ | B. | CO32-和NO3- | C. | CO和N2 | D. | H2O和CH4 |
20.某研究性学习小组成员,利用稀硫酸与某金属的反应来探究影响化学反应速率的因素,下表是研究过程中记录的实验数据(表中某些数据记录已模糊不清,个别数据已丢失).若实验操作、数据记录均是正确的,试分析上述数据回答下列问题:
(1)该实验主要是探究金属表面积、硫酸溶液浓度和反应温度对反应速率的影响.
(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理.
(1)该实验主要是探究金属表面积、硫酸溶液浓度和反应温度对反应速率的影响.
(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理.
| 实验序号 | 金属质量(g) | 金属状态 | C(H2SO4)(mol/L) | V(H2SO4)(mL) | 溶液温度(℃) | 金属消失的时间(s) | |
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 数据模糊 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 数据模糊 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 数据丢失 | 44 | 40 |
17.将少量的CO2通入下列溶液中,不能产生沉淀的是( )
| A. | 氯化钙溶液 | B. | 石灰水 | C. | 氢氧化钡溶液 | D. | 硅酸钠溶液 |
4.下列说法正确的是( )
| A. | 烷烃C5H12的同分异构体中,主链最短的一种系统命名为2,2-甲基丙烷 | |
| B. | 用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛 | |
| C. | 由甘氨酸、丙氨酸形成的二肽有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
14.化学与环境、生活密切相关,下列与化学有关的说法正确的是( )
| A. | 春节燃放爆竹对环境无污染 | |
| B. | “酸雨”是由大气中的碳、氮、硫的氧化物溶于雨水造成 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 光化学烟雾的产生与人为排放大气污染物氮氧化物无关 |
18.某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果.
实验Ⅰ(图1)
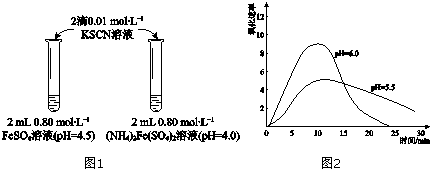
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是NH4++H2O?NH3•H2O+H+(用化学用语表示).溶液的稳定性:
FeSO4<(NH4)2Fe(SO4)2(填“>”或“<”).
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性.进行实验Ⅱ,否定了该观点,补全该实验.
(3)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ:分别配制0.80mol•L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短.资料显示:亚铁盐溶液中存在反应 4Fe2++O2+10H2O?4Fe(OH)3+8H+.由实验Ⅲ,乙同学可得出的结论是溶液pH越小,Fe2+越稳定,原因是溶液中存在平衡4Fe2++O2+10H2O?4Fe(OH)3+8H+,c(H+)大,对平衡的抑制作用强,Fe2+更稳定.
(4)进一步研究在水溶液中Fe2+的氧化机理.测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图2(实验过程中溶液温度几乎无变化).反应初期,氧化速率都逐渐增大的原因可能是生成的Fe(OH)3对反应有催化作用.
(5)综合以上实验,增强Fe2+稳定性的措施有加一定量的酸,密封保存.
实验Ⅰ(图1)

| 物质 | 0min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
FeSO4<(NH4)2Fe(SO4)2(填“>”或“<”).
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性.进行实验Ⅱ,否定了该观点,补全该实验.
| 操作 | 现象 |
| 取取2mLpH=4.0的0.80mol•L-1FeSO4溶液,加加2滴0.01mol•L-1KSCN溶液,观察. | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同. |
(4)进一步研究在水溶液中Fe2+的氧化机理.测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图2(实验过程中溶液温度几乎无变化).反应初期,氧化速率都逐渐增大的原因可能是生成的Fe(OH)3对反应有催化作用.
(5)综合以上实验,增强Fe2+稳定性的措施有加一定量的酸,密封保存.
19.处于固体状态的下列物质,其晶体类型按照离子晶体、分子晶体、原子晶体顺序排列的是( )
| A. | CH3COONH4、H2O、水晶 | B. | H2SO4、硫磺、石墨 | ||
| C. | KOH、SO3、Ar | D. | Ba(OH)2、玻璃、金刚石 |