题目内容
15.实验室中H2SO4、NaOH是两种常见试剂.(1)现在实验室中有一瓶98%的浓H2SO4,(p=l.84g/cm3)
①该硫酸的物质的量浓度为18.4 mol/L.
②现要配置2.0mol/L的稀H2SO4250ml,请回答如下问题:需要量取浓H2SO4mL27.2(保留一位小数).
在该实验使用的玻璃仪器中除烧杯、玻璃棒、胶头滴管、量筒外,还有250mL容量瓶;
(2)有一瓶NaOH固体由于放置时间较长,某同学怀疑其由于吸收空气中CO2而发生部分变质.为证明此推测,进行如下实验.
称取2.000g样品,配制成250ml待测液.量取20.00ml待测液,当慢慢滴入0.1000mol/L的硫酸溶液18.60ml时测得溶液正好显中性.根据实验数据可知:
待测溶液中氢氧化钠的浓度为0.143mol/L;
样品中NaOH的质量百分数为71.25%.
由此,该同学得出结论:样品已部分变质.
①请你对验进行评价(假定实验操作过积准确无误):
A.该实验不能证明关于“部分变质”的推测
B.该实验可以证明关于“部分变质”的推测
C.若样品中混有少量KOH,也能使其质量百分数变小
②在用NaOH固体配制溶液过程中,下列操作中也会造成NaoH质量百分数偏小的是ABCD(填字母).
A.在称量时,把氢氧化钠样品放在称量纸上进行称量
B.在溶解过程中,仓少量液体溅出
C.在转移过程中,烧杯和玻璃棒没有进行洗涤
D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线水平.
分析 (1)①浓H2SO4的物质的量浓度c=$\frac{1000ρω}{M}$;
②根据溶液稀释前后物质的量不变即c(稀)V(稀)=c(浓)V(浓)计算所需浓硫酸的体积;根据配制步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作选择仪器;
(2)慢慢滴入0.1000mol/L的硫酸溶液18.60ml时,硫酸的物质的量为0.001860mol,测得溶液正好显中性,说明只有溶质Na2SO4生成,其物质的量为0.001860mol,设20.00ml待测液中NaOH、Na2CO3的物质的量分别为xmol、ymol,根据钠守恒:xmol+ymol×2=0.001860mol×2以及40x+106y=2.000g×$\frac{20mL}{250mL}$解出NaOH、Na2CO3的物质的量,然后求出氢氧化钠的物质的量浓度以及质量百分数;
①根据上述计算结果分析;
②根据溶质的物质的量和溶液的体积引起变化,利用c=$\frac{n}{V}$分析.
解答 解:(1)①浓H2SO4的物质的量浓度c(H2SO4)=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L;
故答案为:18.4;
②根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=250ml×2.0mol/L,解得:x≈27.2,所以量取的浓硫酸体积是27.2mL;配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到250ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为玻璃棒、烧杯、胶头滴管、量筒、250mL容量瓶,则缺少仪器250mL容量瓶;
故答案为:27.2;250mL容量瓶;
(2)慢慢滴入0.1000mol/L的硫酸溶液18.60ml时,硫酸的物质的量为0.001860mol,测得溶液正好显中性,说明只有溶质Na2SO4生成,其物质的量为0.001860mol,设20.00ml待测液中NaOH、Na2CO3的物质的量分别为xmol、ymol,根据钠守恒:xmol+ymol×2=0.001860mol×2以及40x+106y=2.000g×$\frac{20mL}{250mL}$,解得:x=0.00286mol、y=0.00043mol,氢氧化钠的质量为0.00286mol×40g/mol=0.1144g,物质的量浓度$\frac{0.00286mol}{0.02L}$=0.143moL/mol,样品中NaOH的质量百分数为$\frac{0.1144g}{2.000g×\frac{20.00ml}{250ml}}$×100%=71.25%;
故答案为:0.143;71.25%;
①由上述计算结果可知证明关于“部分变质”的推测,等质量的KOH中和硫酸的体积小于等质量的NaOH中和硫酸的体积,所以导致滴入的硫酸体积偏小,Na2CO3的物质的量偏大,氢氧化钠的物质的量偏大,质量百分数变大;
故选B.
②A.在称量时,把氢氧化钠样品放在称量纸上进行称量,氢氧化钠具有吸湿性,易潮解,溶质的物质的量偏小,根据c=$\frac{n}{V}$分析,氢氧化钠浓度减小,质量百分数偏小,故A正确;
B.在溶解过程中,少量液体溅出,溶质的物质的量偏小,根据c=$\frac{n}{V}$分析,氢氧化钠浓度减小,质量百分数偏小,故B正确;
C.在转移过程中,烧杯和玻璃棒没有进行洗涤,溶质的物质的量偏小,根据c=$\frac{n}{V}$分析,氢氧化钠浓度减小,质量百分数偏小,故C正确;
D.在定容时,滴加蒸馏水超过刻度线,用滴管从容量瓶中小心取出多余液体至液体凹液面与刻度线水平,溶质的物质的量偏小,根据c=$\frac{n}{V}$分析,氢氧化钠浓度减小,质量百分数偏小,故D正确;
故答案为:ABCD.
点评 本题主要考查一定物质的量浓度溶液的配制与物质含量的测定,比较基础,注意测定原理的掌握,难度中等.

| A. | 1.8 mol | B. | 3.6 mol | C. | 100 mol | D. | 200 mol |
| A. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Cu2+、Cl-、SO${\;}_{4}^{2-}$一定能大量共存 | |
| B. | 加入金属钠有氢气产生的水溶液中:K+、Na+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$四种离子一定不能大量共存 | |
| C. | 银氨溶液中加入足量的盐酸:Ag(NH3)${\;}_{2}^{+}$+OH-+3H++Cl-=H2O+AgCl↓+2NH${\;}_{4}^{+}$ | |
| D. | pH=2的氯水加水稀释10倍,稀释后的氯水的pH=3 |
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照下表所示的方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
同学们进行实验时没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进方法是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中)(填一种即可).
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示.
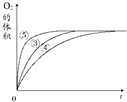 分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.Ⅱ.若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2L固定容积的密闭容
器中,5min后反应达平衡时,n(N2)=1.2mol,n(H2)=1.2mol,n(NH3)=0.8mol,则反应速率v(N2)=0.04mol/(L•mim),平衡常数=1.23(mol/L)-2(保留两位小数).若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡向右(填向左、向右或不移动)移动.
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL 2.5mol/L的硫酸,10s时收集产生的H2体积为50mL(若折合成标准状况下的H2体积为44.8mL),用锌粒来表示10s内该反应的速率为0.013g/s;
(2)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是C(填序号).
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
(1)该实验主要是探究金属表面积、硫酸溶液浓度和反应温度对反应速率的影响.
(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理.
| 实验序号 | 金属质量(g) | 金属状态 | C(H2SO4)(mol/L) | V(H2SO4)(mL) | 溶液温度(℃) | 金属消失的时间(s) | |
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 数据模糊 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 数据模糊 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 数据丢失 | 44 | 40 |
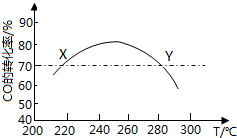 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )| A. | X、Y两点对应的CO正反应速率相等 | |
| B. | 合成二甲醚的正反应△H<0 | |
| C. | 反应温度应控制在260℃~280℃之间 | |
| D. | 选择合适催化剂,可以提高CO转化率 |
| A. | 烷烃C5H12的同分异构体中,主链最短的一种系统命名为2,2-甲基丙烷 | |
| B. | 用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛 | |
| C. | 由甘氨酸、丙氨酸形成的二肽有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
(1)C元素在元素周期表中的位置第三周期第ⅥA族.B形成的简单离子的结构示意图
 .
.(2)上述八种元素的最高价氧化物对应的水化物中酸性最强的是HClO4(填化学式).
(3)用电子式表示A、D形成化合物的过程:
 .
.(4)H、E形成原子个数比为1:1的化合物中所含化学键类型为离子键、共价键.
(5)GE2的电子式为
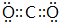 ,F与G形成的最简单的化合物的结构式为
,F与G形成的最简单的化合物的结构式为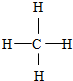 .
.(6)E的氢化物比C的氢化物的熔沸点高的原因是H2O分子间存在氢键,H2S分子间不存在氢键.
(7)A、B、C、E原子半径由大到小的顺序为(用元素符号表示)Mg>Al>S>O.