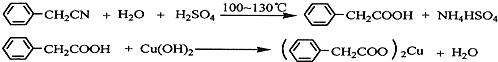
题目内容
7. 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程所需用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和250 mL容量瓶
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液的仪器是25mL酸式滴定管(或25mL移液管).
②滴定时,KMnO4溶液应装在酸式 (填“酸式”、“碱式”)滴定管中.
③滴定时所发生反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
④滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/m L | 滴定后读数/m L | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是BD.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
分析 (1)①配制准确浓度的草酸溶液,所需要的实验仪器主要有托盘天平(含砝码)、烧杯、药匙、250mL容量瓶、胶头滴管、玻璃棒等;
(2)①根据量取液体的精确度选择仪器;
②高锰酸钾具有强氧化性;
③H2C2O4反应中C由+3价升高为二氧化碳中+4价,MnO4 -中Mn由+7价降为Mn2+中的+2价,依据氧化还原反应得失电子守恒结合原子个数守恒书写方程式;
④草酸反应完毕,加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色,说明滴定达到终点;
(3)①根据滴定管的结构和精确度;
②先分析数据的有效性,依据滴定管读数读出消耗溶液最后的体积,求出消耗酸性KMnO4溶液的平均体积,然后根据关系式:5H2C2O4~2MnO4-求出H2C2O4的物质的量和质量,再计算草酸晶体的纯度;
(4)根据c(待测)=$\frac{c标准•V标准}{V待测}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)①配制准确浓度的草酸溶液,所需要的实验仪器主要有托盘天平(含砝码)、烧杯、药匙、250mL容量瓶、胶头滴管、玻璃棒等,所以此操作过程必须用到的2种定量仪器是托盘天平、250mL容量瓶;
故答案为:250mL容量瓶;
(2)①量取25.00mL草酸溶液,精确度为0.01mL,可以使用25mL酸式滴定管(或25mL移液管);
故答案为:25mL酸式滴定管(或25mL移液管);
②高锰酸钾具有强氧化性,可以腐蚀碱式滴定管的橡皮管,所以KMnO4溶液应装在酸式滴定管中;
故答案为:酸式;
③H2C2O4反应中C由+3价升高为二氧化碳中+4价,MnO4 -中Mn由+7价降为Mn2+中的+2价,要使氧化剂与还原剂得失电子相等则H2C2O4系数为5,MnO4 -系数为2,结合原子个数守恒,反应方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O;
④草酸反应完毕,加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色,说明滴定达到终点;
故答案为:加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色;
(3)①滴定时的滴定管中的液面,其读数为22.80mL,故答案为:22.80;
②三次消耗酸性KMnO4溶液体积分别为:20.38mL、20.40mL、20.42mL,三次滴定数据都是有效的,三次消耗盐酸的平均体积为20.40mL,
根据关系式5H2C2O4~2MnO4-可知,n(H2C2O4)=$\frac{5}{2}$n(MnO4-)=$\frac{5}{2}$×0.2000 mol/L×0.0204mL=0.0102mol,
所以25.00mL待测溶液含有:m(H2C2O4•2H2O)═n•M═0.0102mol×126g/mol=1.2852g,
所以250.00 mL待测溶液含有m(H2C2O4•2H2O)═1.2852g×$\frac{250}{25}$=12.852g,
草酸晶体的纯度ω(H2C2O4•2H2O)=$\frac{12.852g}{13g}$×100%=98.86%;
故答案为:98.86%;
(4)A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘,因称量时不需要用游码,则无影响,若需要用游码,则药品质量会偏低,故A错误;
B.用草酸溶液润洗,草酸的物质的量增加,使测定结果偏高,故B正确;
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c标准•V标准}{V待测}$分析,测定结果偏低,故C错误;
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c标准•V标准}{V待测}$分析,使测定结果偏高,故D正确;
故选BD.
点评 本题考查氧化还原滴定原理与应用,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 光照新制的氯水时,溶液黄绿色变浅 | |
| B. | 高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)?2NH3(g);△H<0) | |
| C. | 打开汽水瓶时,有大量气泡逸出 | |
| D. | 氨水应密闭保存于低温处 |
 现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:①向溶液中加入1~2滴指示剂 ②取20mL标准溶液放入锥形瓶中
③用氢氧化钠溶液滴定至终点 ④重复以上操作
⑤用天平精确称取5.105g邻苯二甲酸氢钾(相对分子质量为204.2)固体配成250mL标准溶液(测得pH约为4.2).
⑥根据实验数据计算氢氧化钠的物质的量浓度.
(1)以上各步中,正确的(填序号)操作顺序是⑤②①③④⑥,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是酸式滴定管.选用指示剂是:酚酞
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
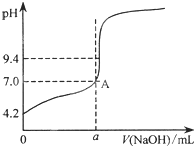
V(NaOH)=$\frac{19.98+20.00+20.80+20.02}{4}$20.20mL,他的计算合理吗?理由是不合理;第3组数据和其他三组相差较大,不应采用
通过仪器测得第4次滴定过程中溶液pH随加入氢 氧化钠溶液体积的变化曲线如图所示,则a<20.02(填“>”、“<”或“=”)
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作快速放液.
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的氢氧化钠溶液滴定,此操作对实验结果偏小(填“偏大”、“偏小”或“无影响”)
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
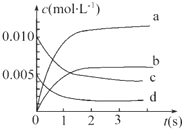
(2)如图中表示NO2变化曲线的是b.用O2表示0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为:PbO2+Pb+2H2SO4═2PbSO4↓+2H2O,据此判断工作时正极反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O.
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量无污染物质并放出大量热.反应的化学方程式为N2H4+2H2O2=N2+4H2O.
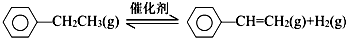
(1)已知:
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
(2)维持体系温度和总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})V}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)如图所示:
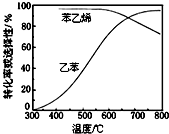
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动.
②控制反应温度为600℃的理由是600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能失催化剂失去活性,且消耗能量较大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺-乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用.
| A. | 在相同温度下,饱和溶液一定比不饱和溶液导电性强 | |
| B. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| C. | 晶体NaCl不导电,所以它不是电解质,而铜、铁等金属能导电,所以它们是电解质 | |
| D. | 氯化氢溶于水能导电,但液态氯化氢不导电 |
 (过氧乙酸)+H2O
(过氧乙酸)+H2O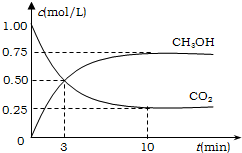 工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.