题目内容
15.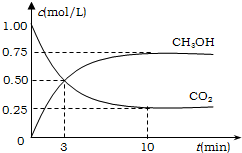 工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇.为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.(1)从反应开始到平衡,氢气的平均反应速率v(CO2)=0.075mol/(L•min);
(2)氢气的转化率=75%;
(3)求此温度下该反应的平衡常数K=5.33;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是AD
A.将H2O(g)从体系中分离出去
B.充入He(g),使体系压强增大
C.升高温度
D.再充入1mol CO2和3mol H2
(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,待反应再一次达到平衡后,CO2的物质的量浓度为c2,则c1< c2(填>、<、=)
分析 由图象可知 CO2(g)+3H2(g)  CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
以此可计算(1)、(2)、(3)题;
(4)要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,平衡正向移动,CH3OH(g)、H2O浓度增大,结合平衡常数不变判断.
解答 解:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
(1)v(CO2)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),故答案为:0.075;
(2)氢气的转化率=$\frac{2.25}{3}$×100%=75%,
故答案为:75%;
(3)衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.33,
故答案为:5.33;
(4)要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故A正确;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故C错误;
D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:AD;
(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,平衡正向移动,CH3OH(g)、H2O浓度增大,由于平衡常数不变,则CO2的物质的量浓度也增大,
故答案为:<.
点评 本题考查较为综合,涉及化学平衡计算以及平衡移动等问题,为高考常见题型,题目难度较大,注意根据图象计算各物质的平衡浓度为解答该题的关键.


| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①②③ |
Ⅰ.配制0.50mol•L-1NaOH溶液
(1)若实验中大约要使用470mL NaOH溶液,至少需要称量NaOH固体10.0 g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):a、b、e.
| 名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  | |
| 序号 | a | b | c | d | e | f |
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.①请填写下表中的空白:
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)A、C、D.
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
| A. | 在有AgCl沉淀的溶液中加入NaC1固体,c(Ag+)减小 | |
| B. | 室温下100mL pH=1.3的Ba(OH)2溶液中OH-的物质的量为0.02 mol | |
| C. | 稀释0.1 mol/L的NH3•H2O溶液,溶液中所有离子浓度均减小 | |
| D. | 溶液中水电离出c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程所需用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和250 mL容量瓶
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液的仪器是25mL酸式滴定管(或25mL移液管).
②滴定时,KMnO4溶液应装在酸式 (填“酸式”、“碱式”)滴定管中.
③滴定时所发生反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
④滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/m L | 滴定后读数/m L | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是BD.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
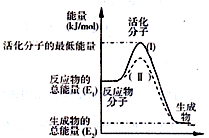 已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q
已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q(1)写出反应的平衡常数表达式:K=$\frac{{c}^{2}(S{{O}_{4}}^{2-})c({{I}_{3}}^{-})}{{c}^{3}({I}^{-})c({S}_{2}{{O}_{8}}^{2-})}$.
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q>0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是(II)曲线.
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大.如表是在20℃进行实验时所记录的数据
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
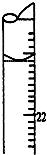 学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分为:
学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分为: 二氧化碳的捕捉和利用是能源领域的一个重要战略方向.
二氧化碳的捕捉和利用是能源领域的一个重要战略方向.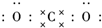 ,所含化学键的类型是共价键.
,所含化学键的类型是共价键.