题目内容
16.下列事实不能用勒夏特列原理解释的是( )| A. | 光照新制的氯水时,溶液黄绿色变浅 | |
| B. | 高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)?2NH3(g);△H<0) | |
| C. | 打开汽水瓶时,有大量气泡逸出 | |
| D. | 氨水应密闭保存于低温处 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.黄绿色的氯水中存在可逆反应Cl2+H2O?HCl+HClO、2HClO?2HCl+O2↑,光照后促进HClO分解,导致平衡右移,所以颜色变浅,可以用勒夏特里原理解释,故A不选;
B、合成氨是放热反应,升高温度平衡向逆反应方向移动,所以抑制氨气的生产,所以温度过高不利于合成氨生产,不可以用勒夏特里原理解释,故B选;
C、因溶液中存在二氧化碳的溶解平衡,打开汽水瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故C不选;
D、氨水中存在化学平衡:NH3+H2O?NH3•H2O,平衡是放热反应温度降低,平衡向生成一水合氨的方向进行,避免氨气挥发,故D不选;
故选B.
点评 本题考查勒夏特里原理,明确勒夏特里原理内涵是解本题关键,知道勒夏特里原理的使用范围及条件,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列有关实验操作或实验数据的说法正确的是( )
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用托盘天平称量25.20g NaCl | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用50.00mL碱式滴定管量取20.00mL氢氧化钾溶液 |
7.下列反应的离子方程式书写正确的是( )
| A. | 用稀硫酸清洗铁锈(Fe2O3):Fe2O3+6H+═2Fe3++3H2O | |
| B. | 铝片与硝酸汞溶液反应:Al+Hg2+═Al3++Hg | |
| C. | 硫酸铜溶液和氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ |
4.下列富含糖类的是( )


| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①②③ |
11.下列关于葡萄糖的说法中,错误的是( )
| A. | 葡萄糖的分子式是C6H12O6 | |
| B. | 葡萄糖是多羟基醛,因而具有醛和多元醇的性质 | |
| C. | 葡萄糖是最简单的醛糖 | |
| D. | 葡萄糖可以通过绿色植物光合作用合成 |
1.下列不属于自发进行的变化是( )
| A. | 红墨水加到清水使整杯水变红 | B. | 冰在室温下融化成水 | ||
| C. | 水往高处流 | D. | 铁器在潮湿的空气中生锈 |
8.在标准状况下,m g气体A与n g气体B分子数相等,下列说法不正确的是( )
| A. | 标准状况下,同体积的气体A和气体B的质量比m:n | |
| B. | 25℃,101KPa时,1Kg气体A与1Kg气体B的分子数比为n:m | |
| C. | 同温同压下,气体A与气体B密度比为n:m | |
| D. | 标准状况下,等质量的A与B的体积比为n:m |
7. 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程所需用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和250 mL容量瓶
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液的仪器是25mL酸式滴定管(或25mL移液管).
②滴定时,KMnO4溶液应装在酸式 (填“酸式”、“碱式”)滴定管中.
③滴定时所发生反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
④滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
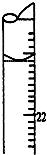
①a的读数如图所示,则a=22.80;
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是BD.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
 某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程所需用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和250 mL容量瓶
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液的仪器是25mL酸式滴定管(或25mL移液管).
②滴定时,KMnO4溶液应装在酸式 (填“酸式”、“碱式”)滴定管中.
③滴定时所发生反应的离子方程式:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O.
④滴定达到终点的标志是加入最后一滴高锰酸钾溶液,锥形瓶内溶液由无色变为红色,且半分钟不褪色.
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 草酸溶液体积 | 酸性KMnO4溶液体积 | |
| 滴定前读数/m L | 滴定后读数/m L | ||
| 第一次 | 25.00 | 0.20 | 20.58 |
| 第二次 | 25.00 | 4.00 | 24.40 |
| 第三次 | 25.00 | 2.38 | a |
②草酸晶体的纯度为98.86%(结果保留两位小数).
(4)在上述实验中,下列操作(其它操作正确)一定会造成测定结果偏高的是BD.
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
 学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分为:
学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分为: