题目内容
11.碳和碳的化合物在生产、生活中有重要的作用.甲醇水蒸气重整制氢系统可能发生下列三个反应:①CH3OH(g)?CO(g)+2H2(g)△H2=+90.8kJ/mol
②CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H2=+49kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)
(1)反应①和②在一定条件下均能自发进行的原因两个反应均为熵增的反应,反应①△H<0,△S>0,则△H-T△S<0,反应②△H>0,△S>0,高温下则△H-T△S<0.
(2)根据化学原理分析升高温度对反应②的影响反应速率加快,有利于向正反应方向移动;
(3)控制反应条件,反应①中的产物也可以用来合成甲醇和二甲醚,其中合成二甲醚的化学方程式为:
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比[$\frac{n({H}_{2})}{n(CO)}$]的变化如图1所示:
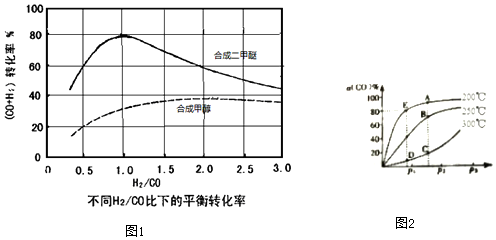
合成二甲醚的最佳氢碳比为1:1,提高二甲醚反应选择的关键因素是催化剂.
(4)将1molCO和2molH2充入密闭容器中生成甲醇CO(g)+2H2(g)?CH3OH(g)△H=-90.1Kjmol-1.在其他条件相同时,CO的平衡转化率[a(CO)]与压强(p)和温度(T)的关系如图2所示
A、B两点CH3OH的质量分数w(A)> w(B)(填“>”、“<”或“=”),理由为该反应为放热反应,A点温度低于B点,升高温度,平衡向逆反应方向移动,CO的平衡转化率减小,CH3OH的质量分数减小.
?C、D两点的逆反应速率:V正(C)> V逆(D)(填“>”、“<”或“=”),理由为该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快.
?200℃时,测得E点的容器容积为10L.该温度下,反应的平衡常数K=2500;保持温度和容积不变,再向容器中冲入1molCO、1molH2和xmolCH3OH时,若使V正>V逆,则x的取值范围为0<x<58.
分析 (1)反应自发进行的判断依据是△H-T△S<0;
(2)CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H2=+49kJ/mol,反应是气体体积增大的吸热反应,升温增大反应速率平衡正向进行;
(3)依据化学方程式定量关系分析按照化学方程式中定量关系是恰好反应的最佳比,反应进行的关键是选择合适催化剂促进反应快速进行;
(4)A、B两点压强一定,温度越高CO的平衡转化率越小,说明升温平衡逆向进行;
CD两点是等温线上的不同点,压强不同,压强越大CO的平衡转化率越大,反应速率越大;
200℃时,测得E点的容器容积为10L.结合化学平衡三行计算列式计算平衡浓度来计算该温度下反应的平衡常数K,保持温度和容积不变,再向容器中冲入1molCO、1molH2和xmolCH3OH时,计算此时浓度商Qc,若使V正>V逆,Qc<K.
解答 解:(1)CH3OH(g)?CO(g)+2H2(g)△H2=+90.8kJ/mol.反应△H<0,△S>0,则△H-T△S<0,反应自发进行,
②CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H2=+49kJ/mol,反应△H>0,△S>0,高温下则△H-T△S<0,反应自发进行,
两个反应均为熵增的反应,反应①△H<0,△S>0,则△H-T△S<0,反应②△H>0,△S>0,高温下则△H-T△S<0,
故答案为:两个反应均为熵增的反应,反应①△H<0,△S>0,则△H-T△S<0,反应②△H>0,△S>0,高温下则△H-T△S<0;
(2)CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H2=+49kJ/mol,反应是气体体积增大的吸热反应,升高温度反应速率加快,升高温度有利于反应②向正反应方向移动,
故答案为:反应速率加快,有利于向正反应方向移动;
(3)3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g),图象分析可知在相同条件下合成二甲醚和合成甲醇的原料平衡转化率随氢碳比增大而减小,合成二甲醚的最佳氢碳比为1:1,此时反应物转化率最大为80%,提高二甲醚反应选择的关键因素是选择催化剂,
故答案为:1:1;催化剂;
(4)A点温度低于B点,该反应为放热反应,升高温度,平衡向逆反应方向移动,故CH3OH的质量分数ω(A)>ω(B),
该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快,逆反应速率:v正(C)>v逆(D),
E点CO转化率为80%,转化的CO为0.8mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):1 2 0
变化量(mol):0.8 1.6 0.8
平衡量(mol):0.2 0.4 0.8
容器体积为10L,则平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{\frac{0.8}{10}}{\frac{0.2}{10}×(\frac{0.4}{10})^{2}}$=2500,
保持温度和容积不变,再向容器中充入1molCO、1molH2和xmolCH3OH时,若使v正>v逆,反应正向进行,则浓度商Qc=$\frac{\frac{0.8+x}{10}}{\frac{1+0.2}{10}×(\frac{1+0.4}{10})^{2}}$<2500,解得x<58,故0<x<58
故答案为:>;该反应为放热反应,A点温度低于B点,升高温度,平衡向逆反应方向移动,CO的平衡转化率减小,CH3OH的质量分数减小;
>;该反应为有气体参与的反应,C点压强大于D点,增大压强,反应速率越快,
2500;0<x<58.
点评 本题考查比较综合,涉及反应热计算、化学平衡图象与影响因素、平衡常数计算及应用、电离平衡常数等,侧重考查学生信息获取与知识迁移运用,题目难度中等.

| A. | 计算机芯片的主要材料是Si | |
| B. | 明矾能使海水淡化从而解决淡水危机 | |
| C. | 可用碘酒灭菌消毒是因为它能使蛋白质变性 | |
| D. | 钠、锶、钡等金属化合物可在燃放时呈现艳丽色彩 |
| A. | NaOH(aq)+HNO3(aq)=NaNO3 (aq)+H2O(l)△H=+28.7kJ•mol-1 | |
| B. | NaOH+HNO3=NaNO3+H2O△H=-28.7kJ•mol-1 | |
| C. | NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=-57.4 kJ |
| A. | 某物质进行焰色反应时呈现黄色,则该物质中一定含有Na+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该溶液中不一定含有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| A. | 加入苛性钠溶液 | B. | 用水湿润 | C. | 加热干燥使用 | D. | 加入少量稀醋酸 |
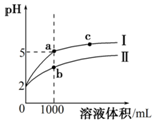 25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )
25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如图所示.下列说法不正确的是( )| A. | 曲线I代表盐酸的稀释过程 | |
| B. | a溶液的导电性比c溶液的导电性强 | |
| C. | a溶液中和氢氧化钠的能力强于b溶液 | |
| D. | 将a、b两溶液加热至30℃,$\frac{c(C{l}^{-})}{c(C{H}_{3}CO{O}^{-})}$变小 |
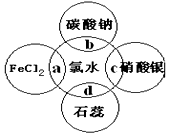 氯水中有多种成分,因而具有多重性质,根据氯水分别与如图四种物质发生的反应,填空a、b、c、d重合部分代表物质间反应,且氯水足量)
氯水中有多种成分,因而具有多重性质,根据氯水分别与如图四种物质发生的反应,填空a、b、c、d重合部分代表物质间反应,且氯水足量)