题目内容
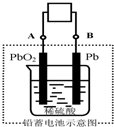 电瓶车所用的电池一般是铅蓄电池,该电池电压稳定,安全可靠,价格低廉,在生产、生活中广泛使用.其电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,该电池电压稳定,安全可靠,价格低廉,在生产、生活中广泛使用.其电池总反应式为:Pb+PbO2+4H++2SO42-
| 放电 |
| 充电 |
(1)电池放电时,负极的电极反应式为
(2)电池充电时,阳极的电极反应式为
(3)放电时,每生成1mol PbSO4,“得到”或“失去”的电子为
考点:常见化学电源的种类及其工作原理
专题:电化学专题
分析:(1)放电时为原电池,负极上铅失电子发生氧化会反应,电子从负极沿导线流向正极;
(2)充电时,阳极上电极反应式与原电池正极电极反应式相反,阳极上失电子发生氧化反应;
(3)根据硫酸铅和转移电子之间的关系式计算.
(2)充电时,阳极上电极反应式与原电池正极电极反应式相反,阳极上失电子发生氧化反应;
(3)根据硫酸铅和转移电子之间的关系式计算.
解答:
解:(1)放电时,该装置是原电池,负极上铅失电子发生氧化会反应,正极是二氧化铅,电极反应式为Pb-2e-+SO42-=PbSO4,电子从负极Pb沿导线流向正极PbO2,即从B沿导线流向A,
故答案为:Pb-2e-+SO42-=PbSO4;B;A;
(2)充电时,二氧化铅作阳极,阳极上电极反应式为PbSO4-2e-+2H2O=PbO2+4H++SO42-,阳极上失电子发生氧化反应,元素化合价升高,
故答案为:PbSO4-2e-+2H2O=PbO2+4H++SO42-;氧化;升高;
(3)Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,根据硫酸铅和转移电子之间的关系式知,转移电子的物质的量=
×2=1mol,故答案为:1.
故答案为:Pb-2e-+SO42-=PbSO4;B;A;
(2)充电时,二氧化铅作阳极,阳极上电极反应式为PbSO4-2e-+2H2O=PbO2+4H++SO42-,阳极上失电子发生氧化反应,元素化合价升高,
故答案为:PbSO4-2e-+2H2O=PbO2+4H++SO42-;氧化;升高;
(3)Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,根据硫酸铅和转移电子之间的关系式知,转移电子的物质的量=
| 1mol |
| 2 |
点评:本题考查了原电池和电解池原理,明确各个电极上发生的反应是解本题关键,结合电子的移动方向、物理量之间的关系式解答即可,难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
酒后驾车人员体内酒精含量的检测装置如图所示,下列说法正确的是( )


| A、该检测装置实现了将化学能转化为电能,且单位时间内通过电量越大,酒精含量越高 |
| B、电极A是正极 |
| C、电极B的反应:H2O+C2H5OH-4e-=CH3COOH+4H+ |
| D、电池总反应:O2+C2H5OH=CH3COOH+H2O |
利用如图所示实验装置进行实验,下列说法正确的是( )


| A、电子将沿着Zn→a→b→Cu路径流动 |
| B、片刻后可观察到试纸a点变蓝色 |
| C、反应一段时间,乙池溶液浓度上升 |
| D、锌电极上发生氧化反应 |
下列离子方程式表达正确的是( )
A、用惰性电极电解熔融氯化钠:2Cl-+2H2O
| ||||
| B、用稀硫酸溶液除去铜表面的氧化铜:CuO+2H+=Cu2++H2O | ||||
| C、常温下,用稀氢氧化钠溶液吸收多余的氯气:Cl2+OH-=Cl-+ClO-+H2O | ||||
| D、苯酚钠溶液中通入少量CO2:C6H5O-+CO2+H2O→C6H5OH+CO32- |
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)△H<0
在恒容的密闭容器中,下列有关说法正确的是( )
| 150℃ |
| 催化剂 |
在恒容的密闭容器中,下列有关说法正确的是( )
| A、平衡时,其他条件不变,升高温度可使该反应的速率加快,平衡常数增大 |
| B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C、平衡时,其他条件不变,增大压强,废气中氮氧化物的转化率减小 |
| D、平衡时,其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |

 四川盛产五倍子.以五倍子为原料可以制得化合物A.A的结构简式如图所示:请回答下列问题:
四川盛产五倍子.以五倍子为原料可以制得化合物A.A的结构简式如图所示:请回答下列问题: .请推断乳酸的结构简式:
.请推断乳酸的结构简式: