题目内容
利用如图所示实验装置进行实验,下列说法正确的是( )


| A、电子将沿着Zn→a→b→Cu路径流动 |
| B、片刻后可观察到试纸a点变蓝色 |
| C、反应一段时间,乙池溶液浓度上升 |
| D、锌电极上发生氧化反应 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据图片知,Zn作负极,Cu作正极,则a是阴极,b是阳极,
A.电子从负极流向阴极,再从阳极流向正极;
B.a电极上氢离子失电子生成氢气;
C.乙池中铜离子放电;
D.锌作负极,负极上失电子发生氧化反应.
A.电子从负极流向阴极,再从阳极流向正极;
B.a电极上氢离子失电子生成氢气;
C.乙池中铜离子放电;
D.锌作负极,负极上失电子发生氧化反应.
解答:
解:根据图片知,Zn作负极,Cu作正极,则a是阴极,b是阳极,
A.电子从负极流向阴极,再从阳极流向正极,所以电子将沿着Zn→a、b→Cu路径流动,故A错误;
B.a电极上氢离子失电子生成氢气,阳极上生成碘单质,碘遇淀粉试液变蓝色,所以b点变蓝色,故B错误;
C.乙池中铜离子放电生成铜导致,所以溶液浓度减小,故C错误;
D.锌作负极,负极上失电子发生氧化反应,电极反应式为Zn-2e-=Zn 2+,故D正确;
故选D.
A.电子从负极流向阴极,再从阳极流向正极,所以电子将沿着Zn→a、b→Cu路径流动,故A错误;
B.a电极上氢离子失电子生成氢气,阳极上生成碘单质,碘遇淀粉试液变蓝色,所以b点变蓝色,故B错误;
C.乙池中铜离子放电生成铜导致,所以溶液浓度减小,故C错误;
D.锌作负极,负极上失电子发生氧化反应,电极反应式为Zn-2e-=Zn 2+,故D正确;
故选D.
点评:本题考查了原电池和电解池原理,根据各个电极上发生的电极反应结合电子移动方向分析解答,易错选项是A,注意电子不进入电解质溶液中,电解质溶液是通过离子定向移动形成电流,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式书写不正确的是( )
| A、氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl- | ||||
B、等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合:Ca2++2HC
| ||||
C、用氢氧化钠溶液吸收少量二氧化碳:2OH-+CO2=C
| ||||
| D、将CO2通入次氯酸钙溶液可生成次氯酸:CO2+H2O+Ca2++2ClO-=CaCO3↓+2HClO |
下列离子方程式书写正确的是( )
| A、氧化铝与稀盐酸反应:Al2O3+6H+=2Al3++3H2O |
| B、氯化铵溶液与氢氧化钠溶液共热:NH4++OH-═NH3?H2O |
| C、碳酸氢钠的水解:HCO3-+H2O?H3O++CO32- |
| D、硫酸亚铁溶液中加双氧水:Fe2++2H2O2+4 H+=Fe3++4H2O |
现有物质的量浓度均为0.1mol?L-1的 ①NaOH溶液 ②Na2CO3溶液 ③CH3COONa溶液各25mL,下列说法正确的是( )
| A、3种溶液pH的大小顺序是 ①>②>③ |
| B、若将3种溶液稀释相同倍数,pH变化最大的是③ |
| C、若分别加入25mL0.1mol?L-1盐酸后,pH最大的是② |
| D、若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
下列离子方程式不正确的是( )
A、用两个铜电极电解饱和食盐水:2Cl-+2H2O
| ||||
| B、AgCl悬浊液中加入硫化钠饱和溶液:2AgCl+S2-=Ag2S+2Cl- | ||||
| C、氢氧化镁与稀硫酸反应:H++OH-=H2O | ||||
D、向20mL沸水中滴入1mL饱和FeCl3溶液,继续煮沸至溶液呈红褐色:Fe3++3H2O
|
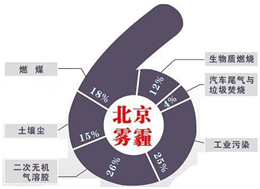 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.

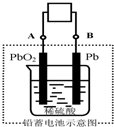 电瓶车所用的电池一般是铅蓄电池,该电池电压稳定,安全可靠,价格低廉,在生产、生活中广泛使用.其电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,该电池电压稳定,安全可靠,价格低廉,在生产、生活中广泛使用.其电池总反应式为: