题目内容
16.下列各组混合物的分离或提纯应选用哪种方法?(填写主要的操作方法即可)(1)分离饱和食盐水和沙子的混合物,用过滤.
(2)除去Cl2中少量的HCl,用洗气.
(3)氯化钠溶液和碘的水溶液,用萃取.
(4)分离乙醇与水的混合物,用蒸馏.
(5)分离水和苯的混合物,用分液.
分析 (1)沙子不溶于水,NaCl溶于水;
(2)食盐水抑制Cl2的溶解,HCl极易溶于水;
(3)碘不易溶于水,易溶于有机溶剂;
(4)乙醇与水互溶,但沸点不同;
(5)水和苯的混合物分层.
解答 解:(1)沙子不溶于水,NaCl溶于水,则选择过滤法分离,故答案为:过滤;
(2)食盐水抑制Cl2的溶解,HCl极易溶于水,则利用饱和食盐水洗气,故答案为:洗气;
(3)碘不易溶于水,易溶于有机溶剂,则选择有机溶剂萃取、分液分离,故答案为:萃取;
(4)乙醇与水互溶,但沸点不同,则选择蒸馏法分离,故答案为:蒸馏;
(5)水和苯的混合物分层,则选择分液法分离,故答案为:分液.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
7. 图为北京奥运会的奖牌--“金镶玉”牌,使用了昂贵的玉石材料,其化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2等.下列说法正确的是( )
图为北京奥运会的奖牌--“金镶玉”牌,使用了昂贵的玉石材料,其化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2等.下列说法正确的是( )
 图为北京奥运会的奖牌--“金镶玉”牌,使用了昂贵的玉石材料,其化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2等.下列说法正确的是( )
图为北京奥运会的奖牌--“金镶玉”牌,使用了昂贵的玉石材料,其化学成分多为含水钙镁硅酸盐,如Ca2Mg5Si8O22(OH)2等.下列说法正确的是( )| A. | Ca2Mg5Si8O22(OH)2可用氧化物的形式表示为2CaO•5MgO•8SiO2•H2O | |
| B. | 从分类的角度看,Ca2Mg5Si8O22(OH)2为氧化物 | |
| C. | 玉石材料性质稳定,耐强酸和强碱的腐蚀 | |
| D. | Ca2Mg5Si8O22(OH)2易溶于水 |
4.下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素.
(1)E在元素周期表中的位置是第四周期第Ⅷ族.
(2)B和D对应的气态氢化物中,稳定性强的是H2O,熔沸点高的是H2O(用具体的化学式表示).
(3)D的单质与烧碱水溶液加热时发生自身氧化还原反应生成两种具有强还原性的阴离子,写出该反应的离子方程式3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$SO32-+2S2-+3H2O.
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1:2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式2N2H4+N2O4$\frac{\underline{\;点燃\;}}{\;}$3N2+4H2O.
(5)以上这五种元素组成一种工业上用途极广的复盐,该物质中A、B、C、D、E的质量比为5:56:7:16:14.则其水溶液的pH<7(填“>”“=”或“<”),原因是Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O+H+(用离子方程式表示).溶液中离子浓度从大到小的顺序为c(NH4+)>c(SO42-)>c(Fe2+)>c(H+)>c (OH-).
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂. |
| D | 室温下其单质呈粉末固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等. |
(2)B和D对应的气态氢化物中,稳定性强的是H2O,熔沸点高的是H2O(用具体的化学式表示).
(3)D的单质与烧碱水溶液加热时发生自身氧化还原反应生成两种具有强还原性的阴离子,写出该反应的离子方程式3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$SO32-+2S2-+3H2O.
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1:2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式2N2H4+N2O4$\frac{\underline{\;点燃\;}}{\;}$3N2+4H2O.
(5)以上这五种元素组成一种工业上用途极广的复盐,该物质中A、B、C、D、E的质量比为5:56:7:16:14.则其水溶液的pH<7(填“>”“=”或“<”),原因是Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O+H+(用离子方程式表示).溶液中离子浓度从大到小的顺序为c(NH4+)>c(SO42-)>c(Fe2+)>c(H+)>c (OH-).
1.下列分子中所有原子都满足最外层为8电子结构的是( )
①BeCl2 ②NCl3 ③PCl5 ④COCl2 ⑤SF6 ⑥XeF2 ⑦CS2 ⑧CH4 ⑨CF2Cl2.
①BeCl2 ②NCl3 ③PCl5 ④COCl2 ⑤SF6 ⑥XeF2 ⑦CS2 ⑧CH4 ⑨CF2Cl2.
| A. | ②④⑦⑧⑨ | B. | ②④⑦⑨ | C. | ③④⑦ | D. | ④⑤⑦⑨ |
8.下列物质加入AgNO3溶液能产生白色沉淀的是( )
| A. | KClO3 | B. | CH3Cl | C. | CCl4 | D. | 氯水 |
5.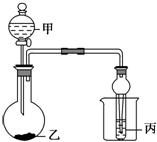 利用图所示装置进行下列实验,能观察到相应现象并得出相应实验结论的是( )
利用图所示装置进行下列实验,能观察到相应现象并得出相应实验结论的是( )
 利用图所示装置进行下列实验,能观察到相应现象并得出相应实验结论的是( )
利用图所示装置进行下列实验,能观察到相应现象并得出相应实验结论的是( )| 选项 | 甲 | 乙 | 丙 | 实验现象 | 实验结论 |
| A | 浓盐酸 | 石灰石 | NaAlO2溶液 | 乙中有无色气泡,丙中先出现沉淀后消失 | 氢氧化铝溶于碳酸 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 乙中蔗糖变黑色、丙中溴水褪色 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | 乙中有无色气泡,丙中出现白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 乙中有无色气泡,丙中出现白色沉淀 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
6.下列是某同学对相应反应的离子方程式所作的评价,其中评价完全合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | Cu和AgNO3溶液反应 | Cu+Ag+═Cu2++Ag | 正确 |
| B | 氧化铝与NaOH溶液反应 | 2Al3++3O2-+2OH-═2AlO2-+H2O | 错误,Al2O3不应写成离子形式 |
| C | Fe和稀硫酸反应 | 2Fe+6H+═2Fe3++3H2↑ | 正确 |
| D | 钠与硫酸铜溶液反应 | 2Na+Cu2+═Cu+2Na+ | 错误,CuSO4不应写成离子形式 |
| A. | A | B. | B | C. | C | D. | D |