题目内容
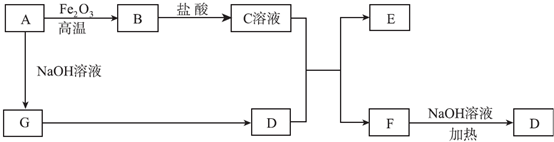
4.下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素.| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂. |
| D | 室温下其单质呈粉末固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等. |
(2)B和D对应的气态氢化物中,稳定性强的是H2O,熔沸点高的是H2O(用具体的化学式表示).
(3)D的单质与烧碱水溶液加热时发生自身氧化还原反应生成两种具有强还原性的阴离子,写出该反应的离子方程式3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$SO32-+2S2-+3H2O.
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1:2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式2N2H4+N2O4$\frac{\underline{\;点燃\;}}{\;}$3N2+4H2O.
(5)以上这五种元素组成一种工业上用途极广的复盐,该物质中A、B、C、D、E的质量比为5:56:7:16:14.则其水溶液的pH<7(填“>”“=”或“<”),原因是Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O+H+(用离子方程式表示).溶液中离子浓度从大到小的顺序为c(NH4+)>c(SO42-)>c(Fe2+)>c(H+)>c (OH-).
分析 由题目信息可知,A为H,B为O,C为N,D为S,E为Fe.
(1)Fe位于第四周期第Ⅷ族;
(2)元素非金属越强,对应氢化物越稳定,H2O由于存在分子间氢键,熔沸点较H2S高;
(3)S与NaOH溶液该反应生成亚硫酸钠、硫化钠与水;
(4)C与A形成的原子个数比为1:2的化合物为N2H4,C与B形成的原子个数比为1:2的化合物为N2O4,N2H4与N2O4反应方程式生成氮气与水;
(5)根据质量比可得五种元素原子个数比为20:14:2:2:1,故此盐为(NH4)2SO4•FeSO4•6H2O,溶液中Fe2+与NH4+均水解,故溶液显酸性.
解答 解:由题目信息可知,A为H,B为O,C为N,D为S,E为Fe.
(1)Fe位于第四周期第Ⅷ族,故答案为:第四周期第Ⅷ族;
(2)非金属性O>S,故H2O和H2S中,H2O稳定性较强,H2O由于存在分子间氢键,所以熔沸点较H2S高,
故答案为:H2O;H2O;
(3)S与NaOH溶液该反应生成亚硫酸钠、硫化钠与水,反应离子方程式为:3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$SO32-+2S2-+3H2O,
故答案为:3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$SO32-+2S2-+3H2O;
(4)C与A形成的原子个数比为1:2的化合物为N2H4,C与B形成的原子个数比为1:2的化合物为N2O4,N2H4与N2O4反应生成氮气与水,反应方程式为:2N2H4+N2O4$\frac{\underline{\;点燃\;}}{\;}$3N2+4H2O,
故答案为:2N2H4+N2O4$\frac{\underline{\;点燃\;}}{\;}$3N2+4H2O;
(5)根据质量比可得H、O、N、S、Ee元素原子个数比为$\frac{5}{1}$:$\frac{56}{16}$:$\frac{7}{14}$:$\frac{16}{32}$:$\frac{14}{56}$=20:14:2:2:1,故此盐为(NH4)2SO4•FeSO4•6H2O,溶液中Fe2+与NH4+均水解:Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O+H+,故溶液显酸性,溶液中各离子浓度由大到小排列为:c(NH4+)>c(SO42-)>c(Fe2+)>c(H+)>c (OH-),
故答案为:<;Fe2++2H2O?Fe(OH)2+2H+、NH4++H2O?NH3•H2O+H+;c(NH4+)>c(SO42-)>c(Fe2+)>c(H+)>c (OH-).
点评 本题考查结构性质位置关系应用,涉及元素化合物性质、元素周期律应用、常用化学用语、物质推断、盐类水解等,熟练掌握元素化合物性质,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 分液、萃取、蒸馏 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸馏、分液 | D. | 蒸馏、萃取、分液 |
| A. | 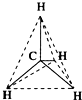 结构示意图 | B. |  电子式 | C. | 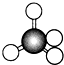 球棍模型 | D. | 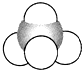 比例模型 |
| A. | 等于2 | B. | 在3~4之间 | C. | 等于3 | D. | 在2~3之间 |
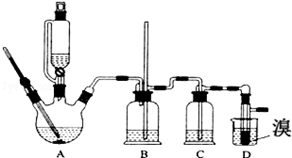
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)写出装置A中的反应方程式为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;同时在装置C中应加入NaOH溶液.其目的是吸收反应中可能生成的酸性气体.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);若产物中有少量未反应的Br2,可用NaOH溶液洗涤除去.
(4)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是如果用冰水冷却会使产品凝固而堵塞导管.
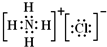 ;
;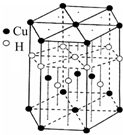 [Cu(NH3)4]SO4•H2O是一种杀虫剂.
[Cu(NH3)4]SO4•H2O是一种杀虫剂.