题目内容
5.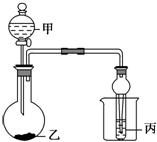 利用图所示装置进行下列实验,能观察到相应现象并得出相应实验结论的是( )
利用图所示装置进行下列实验,能观察到相应现象并得出相应实验结论的是( )| 选项 | 甲 | 乙 | 丙 | 实验现象 | 实验结论 |
| A | 浓盐酸 | 石灰石 | NaAlO2溶液 | 乙中有无色气泡,丙中先出现沉淀后消失 | 氢氧化铝溶于碳酸 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 乙中蔗糖变黑色、丙中溴水褪色 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | 乙中有无色气泡,丙中出现白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 乙中有无色气泡,丙中出现白色沉淀 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.浓盐酸与石灰石反应生成二氧化碳,盐酸易挥发,盐酸、二氧化碳均与偏铝酸钠反应;
B.浓硫酸使蔗糖脱水,C与浓硫酸发生氧化还原反应生成二氧化硫,二氧化硫与溴水发生氧化还原反应;
C.稀盐酸与亚硫酸钠反应生成二氧化硫,丙中二氧化硫与硝酸钡发生氧化还原反应生成硫酸钡;
D.硝酸易挥发,丙中硝酸可与硅酸钠反应.
解答 解:A.浓盐酸与石灰石反应生成二氧化碳,盐酸易挥发,盐酸、二氧化碳均与偏铝酸钠反应,丙中沉淀消失与盐酸有关,结论不合理,故A错误;
B.浓硫酸使蔗糖脱水,C与浓硫酸发生氧化还原反应生成二氧化硫,二氧化硫与溴水发生氧化还原反应,则现象、结论均合理,故B正确;
C.稀盐酸与亚硫酸钠反应生成二氧化硫,丙中二氧化硫与硝酸钡发生氧化还原反应生成硫酸钡,结论不合理,故C错误;
D.硝酸易挥发,丙中硝酸可与硅酸钠反应,不能比较碳酸、硅酸的酸性,结论不合理,故D错误;
故选B.
点评 本题考查实验方案的评价及实验装置的综合应用,为高频考点,把握实验装置的作用、反应原理与实验现象为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
20.下列实验操作中正确的是( )
①用剩的钠或钾应及时放回原试剂瓶
②蒸发硝酸钾溶液时要用玻璃棒不断搅动
③称取易潮解的药品必须放在玻璃器皿中称量
④用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体,观察试纸颜色变化
⑤将吸有氢氧化钠溶液的长胶头滴管伸入硫酸亚铁溶液中再挤出溶液以制得氢氧化亚铁
⑥水玻璃应该盛于磨口玻璃塞的试剂瓶中.
①用剩的钠或钾应及时放回原试剂瓶
②蒸发硝酸钾溶液时要用玻璃棒不断搅动
③称取易潮解的药品必须放在玻璃器皿中称量
④用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体,观察试纸颜色变化
⑤将吸有氢氧化钠溶液的长胶头滴管伸入硫酸亚铁溶液中再挤出溶液以制得氢氧化亚铁
⑥水玻璃应该盛于磨口玻璃塞的试剂瓶中.
| A. | ①③⑥ | B. | ②③④ | C. | ①②③⑤ | D. | ①②③④ |
10.下列有关阿伏加德罗常数NA的说法正确的是( )
| A. | 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成氯气分子数为0.3 NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA | |
| D. | 5.4g铝粉与足量的氢氧化钠溶液充分反应生成氢气分子数为0.3 NA |
14.实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.
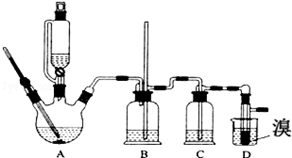
有关数据列表如下:
回答下列问题:
(1)写出装置A中的反应方程式为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;同时在装置C中应加入NaOH溶液.其目的是吸收反应中可能生成的酸性气体.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);若产物中有少量未反应的Br2,可用NaOH溶液洗涤除去.
(4)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是如果用冰水冷却会使产品凝固而堵塞导管.

有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)写出装置A中的反应方程式为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成;同时在装置C中应加入NaOH溶液.其目的是吸收反应中可能生成的酸性气体.
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);若产物中有少量未反应的Br2,可用NaOH溶液洗涤除去.
(4)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是如果用冰水冷却会使产品凝固而堵塞导管.
 ;
;
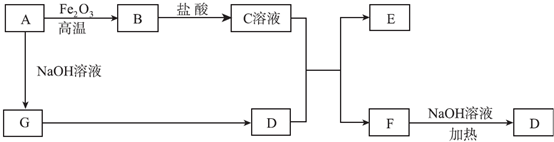
 溶液中的化学反应大多是离子反应.根据要求回答下列问题.
溶液中的化学反应大多是离子反应.根据要求回答下列问题.