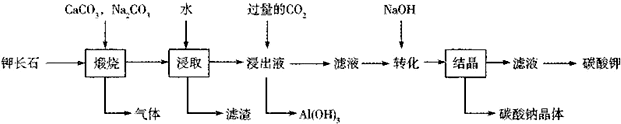
题目内容
14.下列图象表达正确的是( )| A. |  如图:可以表示CO2的比例模型 | |
| B. | 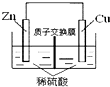 如图表示的锌铜原电池,电池工作一段时间后,右侧溶液的pH不变 | |
| C. | 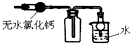 如图:可用于收集干燥氨气 | |
| D. | 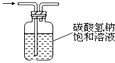 如图:可用于除去氯气中的HCl气体 |
分析 A.由模型可知小球为碳原子,2个大球为氧原子,氧原子半径大,实际碳原子半径大于氧原子半径;
B.Zn为负极,右侧氢离子放电,但质子交换膜可使左侧氢离子进入右侧;
C.无水氯化钙与氨气结合生成络合物;
D.氯气、HCl均与碳酸氢钠溶液反应.
解答 解:A.二氧化碳分子中,碳原子的半径大于氧原子半径,其正确的比例模型为 ,故A错误;
,故A错误;
B.Zn为负极,右侧氢离子放电,但质子交换膜可使左侧氢离子进入右侧,则电池工作一段时间后,右侧溶液的pH不变,故B正确;
C.无水氯化钙与氨气结合生成络合物,则不能干燥氨气,故C错误;
D.氯气、HCl均与碳酸氢钠溶液反应,不能除杂,应选饱和食盐水除杂,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、原电池等为解答的关键,侧重分析与实验能力的考查,注重相关反应原理与实验相结合的训练,注意实验装置的作用及实验评价性分析,题目难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
4.下表为部分短周期主族元素的相关信息.
请回答下列问题:
(1)Z元素在周期表中的位置是第三周期第ⅦA族.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键名称).
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式SO32-+ClO-═SO42-+Cl-.
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子内层电子数是其最外层电子数的三分之一 |
| Y | 在第三周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)Z元素在周期表中的位置是第三周期第ⅦA族.
(2)元素T与X按原子个数比1:1形成的化合物B所含的化学键有离子键、共价键(填化学键名称).
(3)已知1mol化合物A与Na2SO3在溶液中发生反应时,转移2mol电子,写出该反应的离子方程式SO32-+ClO-═SO42-+Cl-.
2.下列说法正确的是( )
| A. | ${\;}_{\;}^{16}{O}_{2}$、${\;}_{\;}^{18}{O}_{2}$互为同位素 | B. | H2O、D2O、T2O的化学性质不同 | ||
| C. | 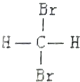 和 和 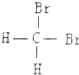 是两种不同结构 是两种不同结构 | D. | 白磷与红磷互为同素异形体 |
9.由于吸水、透气性较好,高分子化合物“维纶”常用于生产内衣、桌布、窗帘等,其结构简式为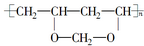 ,它是由聚乙烯醇
,它是由聚乙烯醇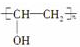 与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )
与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )
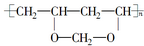 ,它是由聚乙烯醇
,它是由聚乙烯醇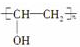 与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )
与另一单体经缩聚反应得到的.若已知缩合过程中有H2O生成,则与聚乙烯醇缩合的单体可能是( )| A. | CH3OH | B. | HCHO | C. | HO-CH2CH2-OH | D. | HCOOH |
19.一种二次电池如图所示,该电池的电解质为强碱溶液,下列说法中正确的是( )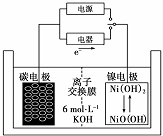

| A. | 充电时阴极发生氧化反应 | |
| B. | 充电时将碳电极与电源的正极相连 | |
| C. | 放电时碳电极反应为H2-2e -=2H+ | |
| D. | 放电时镍电极反应为NiO(OH)+H20+e-=Ni( OH)2+OH - |
3.下列说法错误的是( )
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 0.1 mol•L-1的CH3COOH溶液中,由水电离的c(H+)为10-13 mol•L-1 | |
| C. | 常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液pH<7 | |
| D. | 1.0 mol•L-1Na2CO3溶液:c(OH-)═c(HCO3-)+c(H+)+2c(H2CO3) |
4.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 42g丙烯和环丙烷的混合气体中所含极性键的数目为9NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的数目为0.5NA | |
| C. | 室温下,1L pH=13的NaOH溶液中,由水电离出的OH-的数目为0.1NA | |
| D. | 3.6 g CaO2晶体中阴离子的数目为0.1NA |